
 Al(OH)3+OH-.
Al(OH)3+OH-.
分析 (1)NaAlO2为强碱弱酸盐,水解呈碱性;
(2)计算铁的物质的量为0.1mol,0.1mol铁在金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量QKJ则1mol铁与盐酸反应放出10QkJ热量;
(3)该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-;
(4)FeCl3与铜反应生成氯化亚铁与氯化铜;
(5)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液.
解答 解:(1)NaAlO2为强碱弱酸盐,水解呈碱性,水解的离子方程式为AlO2-+2H2O Al(OH)3+OH-,故答案为:AlO2-+2H2O
Al(OH)3+OH-,故答案为:AlO2-+2H2O Al(OH)3+OH-;
Al(OH)3+OH-;
(2)n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,0.1mol金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量QKJ,其热化学反应方程式为Fe(S)+2HCl(aq)=FeCl2(aq)+H2(g)△H=-10 Q kJ/mol,故答案为:Fe(S)+2HCl(aq)=FeCl2(aq)+H2(g)△H=-10 Q kJ/mol;
(3)通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,正极上的电极反应式为O2+4e-+2CO2═2CO32-,
故答案为:2CO2+4e-+O2=2CO32-;
(4)FeCl3与铜反应生成氯化亚铁与氯化铜,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(5)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: .
.
点评 本题综合考查化学用语,为高频考点,侧重于学生双基的考查,注意把握物质的性质以及原电池工作原理,难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在乙醇分子间,既存在分子间作用力又存在氢键 | |
| B. | 带相反电荷离子之间的相互吸引称为离子键 | |
| C. | 同素异形体间的相互转化属于物理变化 | |
| D. | H2O比H2S稳定,因为水分子间有氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体运动所消耗的能量与化学反应有关 | |
| B. | 煤和石油都属于化石燃料 | |
| C. | 化学反应必然伴随发生能量变化 | |
| D. | 不需要加热就能进行的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,CO的结构可以表示为
,CO的结构可以表示为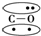 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式为 | |
| B. | S2-的结构示意图为 | |
| C. | O-16原子的符号为${\;}_{6}^{16}O$ | |
| D. | ${\;}_{12}^{6}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$含有相同的中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室可用丁达尔效应鉴别胶体与溶液 | |
| B. | 豆浆制豆腐是利用了胶体聚沉的原理 | |
| C. | 氢氧化铁胶体微粒带负电,通电时胶体微粒向直流动电源正极移动 | |
| D. | 配制氢氧化铁胶体时,可将饱和FeCl3溶液滴入沸水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com