
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 |
分析 在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.所以书写可燃物燃烧热的热化学方程式时,必须保证可燃物计量数为1,C元素转化为CO2,S元素转化为SO2,H元素转化为液态水.
解答 解:A.1molCO完全燃烧生成稳定的CO2,符合燃烧热的概念要求,放出的热量为燃烧热,故A正确;
B.燃烧热是指1mol纯净物完全燃烧,可燃物的计量数不是1,故B错误;
C.燃烧热是指1mol纯净物完全燃烧,方程式中为2mol,并且生成物为稳定的氧化物,水应为液态,所以不是燃烧热,故C错误;
D.1molC不完全燃烧生成CO,不符合燃烧热的概念要求,不是燃烧热,故D错误;
故选A.
点评 本题考查了可燃物燃烧热的热化学方程式的书写,题目难度不大,本题注意紧扣燃烧热的概念.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
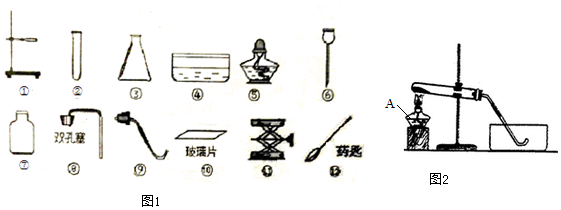
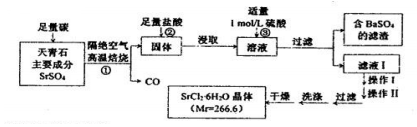
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10 s | B. | 等于15 s | C. | 大于15 s | D. | 小于15 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2HSO4 | |
| B. | a点时剩余NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO43-+I-+3H2O | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )| A. | a的取值范围为0≤a<50 | |
| B. | 当a=30时,$\frac{n(Mg)}{n(Al)}$=1 | |
| C. | 图中0~a段,与NaOH发生反应的微粒是H+ | |
| D. | 当v(NaOH)=90mL时,溶液中的溶质为NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸除铁锈:Fe2O3•xH2O+6H+═2Fe3++(3+x)H2O | |
| B. | Mg(HCO3)2溶液与足量的 NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ | |
| D. | 用NaOH 溶液吸收 NO2:2NO2+2OH-═2NO3-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com