
已知:3Fe2++ NO3-+4H+= 3Fe3++ NO↑+2H2O,对于该反应的下列叙述中,不正确的是
A.氧化剂和还原剂的物质的量之比为1∶3
B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移3 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+- e-=Fe3+
科目:高中化学 来源: 题型:
 已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色).如图连接好装置,往铁电极区滴入2滴黄色的K3[Fe(CN)6](铁氰化钾)溶液.下列说法正确的是( )
已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色).如图连接好装置,往铁电极区滴入2滴黄色的K3[Fe(CN)6](铁氰化钾)溶液.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第16期 总第172期 人教课标版(选修4) 题型:058
某科学实验小组欲用如下图所示的实验装置来验证牺牲阳极的阴极保护法的原理.已知:
3Fe2++2Fe(CN)63-(黄色)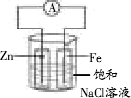
实验步骤如下:
[实验I]向100 mL烧杯中加入约50 mL饱和食盐水后,插入两个玻璃筒(无底).将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,可以看到电流计指针发生偏转.
(1)电流计指针发生偏转的原因是________.锌棒上发生的反应为________,铁棒上发生的反应为________.
(2)可以证明该实验中无Fe2+产生的现象是________.
[实验II]为了进一步探究金属腐蚀的原理,该小组的同学又做了如下实验:
a.向100 mL烧杯中加入约50 mL饱和食盐水后,插入两个玻璃筒(无底);
b.将一根铜棒与一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中;
c.1 min后,向插入铁棒的玻璃筒内滴入2~3滴K3[Fe(CN)6]溶液;
d.向插入铜棒的玻璃筒内滴入酚酞溶液.
(3)b步骤中观察到电流计指针偏转但其偏转方向与实验I相反,表明________.
(4)c步骤中观察到的现象是________,表明________.
(5)d步骤中观察到的现象是________,表明________.
(6)通过上述实验可以得出的结论是________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化剂和还原剂的物质的量之比为1:3 |
| B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1molNO3-发生氧化反应,转移3mole- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市莲湖区远东一中高三(上)月考化学试卷(10月份)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com