
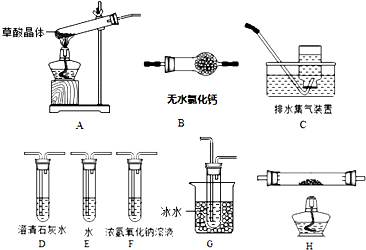
分析 (1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,G装置温度较低,有冷凝作用,防止干扰实验;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO的还原性将CO氧化,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊;
(3)由K可知酸性强弱,发生强酸制取弱酸的反应.
解答 解:(1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成,则证明草酸晶体的分解产物中含有CO2,选用的装置有AGDC;
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,G装置温度较低,有冷凝作用,防止干扰二氧化碳的检验,
故答案为:AGDC;D有气泡冒出,澄清石灰水变浑浊;冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,所以其连接顺序是A、F、D、B、H、D、C;
H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO,
故答案为:A、F、D、B、H、D、C;CuO;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,只要H中黑色固体转化为红色且其后的D装置溶液变浑浊就说明含有CO,
故答案为:H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊;
(3)由K可知酸性强弱,则Na2CO3溶液中滴加少量草酸溶液的离子方程式为2CO32-+H2C2O4=C2O42-+2HCO3-,故答案为:2CO32-+H2C2O4=C2O42-+2HCO3-.
点评 本题考查物质制备实验和性质实验方案设计,为高频考点,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com