
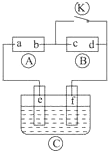
 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e═-H2↑ | ||
| C. | f电极为锌板 | D. | e极发生还原反应 |
分析 A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,以此解答该题.
解答 解:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.接通K前,c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,则c极发生的反应为2H++2e-═H2↑,故B正确;
C.为实现铁上镀锌,锌作阳极,铁作阴极,所以e电极为锌板,故C错误;
D.e电极是阳极,阳极上失电子发生氧化反应,故D错误.
故选B.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合应用的考查,题目难度中等,注意把握电极方程式的书写和判断.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 的水溶液:NaHCO3═Na++H++CO32- | |
| B. | 熔融状态的NaHSO4:NaHSO4═Na++HSO4- | |
| C. | HF的水溶液:HF═H++F- | |
| D. | H2S 的水溶液:H2S?2H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于泡沫灭火剂 | B. | 明矾能做净水剂 | ||
| C. | 氯气可作自来水消毒剂 | D. | 铝热反应可用来焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有双键的有机物一定是烯烃 | |
| B. | 分子里含有苯环和羟基的化合物一定属于酚类 | |
| C. | 醛类的通式是CnH2nO(n≥1) | |
| D. | 相对分子质量为46的烃的含氧衍生物不一定是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过程中可能有:c(Na+)>c(OH-)=c(CH3COO-)>c(H+) | |
| B. | 整个过程中都有:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) | |
| C. | 当滴入10.0 mLNaOH溶液时有:c(CH3COOH)-c(CH3COO-)═2[c(OH-)-c(H+)] | |
| D. | 当滴入10.0 mLNaOH溶液时混合溶液的pH=4.75,则:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com