
分析 (1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e-=2 CO32-;原电池中的阴离子向负极移动,放电时CO32-移向电池的负极;
(2)依据平衡常数概念结合平衡状态下离子浓度和同时浓度计算得到;
(3)0.1mol•L-1NaHCO3溶液的pH大于7,说明碳酸氢根离子的水解程度大于电离程度;已知0.1mol•L-1NaHCO3溶液的pH等于8,则溶液中根据质子守恒:C(H2CO3)+C(H+)═C(CO32-)+C(OH-).
解答 解:(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e-=2 CO32-;原电池中的阴离子向负极移动,放电时CO32-移向电池的负极,
故答案为:C3H8+5O2=3CO2+4H2O;O2+2CO2+4e-=2 CO32-;负;
(2)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L;c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,故答案为:4.2×10-7;
(3)常温下,0.1mol•L-1NaHCO3溶液中存在电离和水解,离子方程式为:HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,的pH大于7,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),已知0.1mol•L-1NaHCO3溶液的pH等于8,则溶液中根据质子守恒:C(H2CO3)+C(H+)═C(CO32-)+C(OH-),所以C(H2CO3)-C(CO32-)═C(OH-)-C(H+)═10-6-10-8═9.9×10-7,
故答案为:>;HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,HCO3-的水解程度大于电离程度;根据质子守恒:C(H2CO3)+C(H+)═C(CO32-)+C(OH-),所以C(H2CO3)-C(CO32-)═C(OH-)-C(H+)═10-6-10-8═9.9×10-7.
点评 本题考查较为综合,涉及离子浓度大小比较、质子守恒等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molSiO2含NASiO2个分子 | |
| B. | 12g金刚石晶体中碳碳单键的数目为2NA | |
| C. | 1L0.1mol/LFeCl3溶液中含Fe3+的数目为0.1NA | |
| D. | 一定条件下,1molN2和3molH2完全反应,电子转移的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
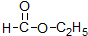 酯; ②
酯; ②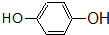 酚;
酚;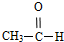 醛;④
醛;④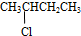 卤代烃;⑤
卤代烃;⑤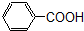 羧酸;
羧酸;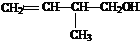
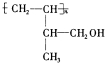 .
. +Cl2→CH2ClCHClCH(CH3)CH2OH.
+Cl2→CH2ClCHClCH(CH3)CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | PbO2得电子,被氧化 | |
| C. | 电池放电时,溶液酸性增强 | |
| D. | 负极的电极反应式为:Pb+SO42--2e -═PbSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)
某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格.(涉及到电极填写具体物质的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
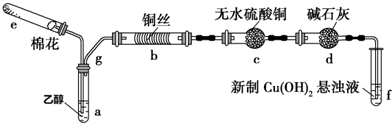
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| B. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 向某溶液中加入硝酸酸化的氯化钡溶液,若生成白色沉淀,溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | 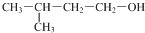 的名称3-甲基-1-丁醇 的名称3-甲基-1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
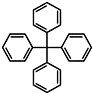
| A. | 分子式为C25H20,属于苯的同系物 | |
| B. | 该物质不能发生硝化反应 | |
| C. | 能使溴水和酸性KMnO4溶液褪色 | |
| D. | 1 mol该物质最多能与12 mol氢气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com