
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

分析 I.(1)沸石有防止液体暴沸作用;醇在一定条件下能发生分子内或分子间脱水生成烯烃或醚;
(2)温度过高会促进乙酸、丁醇挥发,还可能发生副反应;
II.(3)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,除去乙酸、丁醇且降低酯的溶解度,然后进行分液;
(4)①B仪器名称是冷凝管,水应该采用逆流方向;
②收集酯,温度应该控制在酯的沸点左右.
解答 解:I.(1)沸石有防止液体暴沸作用,防止安全事故发生;醇在一定条件下能发生分子内或分子间脱水生成烯烃或醚该条件下,正丁醇能发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,也能形成分子内脱水生成正丁烯CH2=CHCH2CH3;
故答案为:防暴沸;CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3;
(2)温实验发现温度过高,乙酸正丁酯的产率反而降低,是由于乙酸、正丁醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如正丁醇在140℃,在浓硫酸催化下发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3,
故答案为:乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低;
II.(3)将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,乙酸和碳酸钠反应生成乙酸钠、丁醇易溶于饱和碳酸钠溶液,乙酸丁酯在饱和碳酸钠溶液中溶解度小于水中,所以饱和碳酸钠溶液作用是除去乙酸、丁醇、降低酯的溶解度,然后再进行分液得到酯,
故答案为:分液漏斗;分液;
(4)①B仪器名称是冷凝管,水应该采用逆流方向,所以g是进水口、f是出水口,防止蒸气急剧冷却而炸裂冷凝管,故答案为:冷凝管;g;
②乙酸正丁酯的沸点为126.1℃,所以蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右,
故答案为:126.1℃.
点评 本题考查有机物制备,为高频考点,侧重考查学生实验基本操作及对实验原理的理解和掌握,明确实验原理及物质性质是解本题关键,知道常见仪器及其使用方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
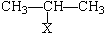 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或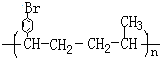
 CHBrCH3.
CHBrCH3. CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.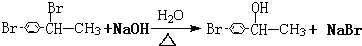 .
.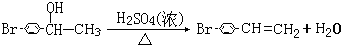 .
.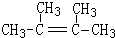 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol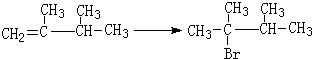
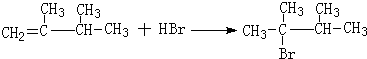
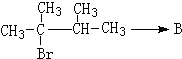
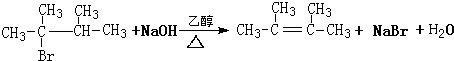 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
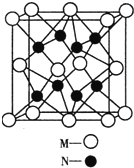 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com