
分析 (1)化铝溶液与氢氧化钠溶液反应时,发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl①,Al(OH)3+NaOH=NaAlO2+2H2O②,若氢氧化钠溶液不足,只发生反应①,现象是生成沉淀;
(2)根据离子方程式:AlO2-+H++H2O=Al(OH)3↓、AlO2-+4H+=Al3++2H2O进行解答.
解答 解:(1)设参与反应的氯化铝物质的量为1mol
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1mol 3mol
AlCl3和NaOH物质的量之比为1:3时,Al(OH)3沉淀量最多;故答案为:1:3;
(2)生成Al(OH)3沉淀量最多,则发生:AlO2-+H++H2O=Al(OH)3↓,则n(AlO2-):n(H+)=1:1;生成的Al(OH)3恰好全部溶解,发生总反应为:AlO2-+4H+=Al3++2H2O,则n(AlO2-):n(H+)=1:4,故答案为:1:4.
点评 本题考查离子方程式计算,比较基础,注意对基础知识的理解掌握.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 测定蒸气的摩尔体积 | |
| B. | 与银氨溶液反应,分析产生银的量 | |
| C. | 与钠反应,分析产生氢气的量 | |
| D. | 用酸性高锰酸钾溶液滴定,分析相关数据 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)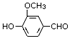 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
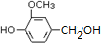 .
.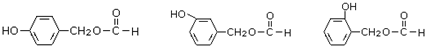 (其中之一).
(其中之一). 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

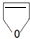 或
或 .
.


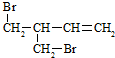
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 二氧化氯消毒液1000mL | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2g/cm3 |
| 强腐蚀性,阴冷,密封储存 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com