
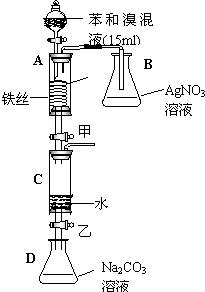
 如图是某校研究性学习小组的同学设计的有关苯与溴在铁作催化剂时反应的实验装置图.请回答下列问题:
如图是某校研究性学习小组的同学设计的有关苯与溴在铁作催化剂时反应的实验装置图.请回答下列问题:| Fe |
| Fe |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:| 实验编号 | 水果种类 | 电极间距离/cm | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹 果 | 2 | 27.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
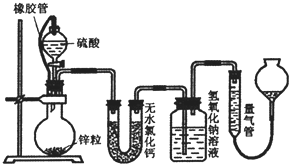 不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.查看答案和解析>>
科目:高中化学 来源: 题型:
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com