
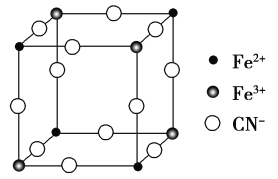
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法正确的是( )。
A. 该晶体属于离子晶体,M呈+1价
B. 该晶体属于离子晶体,M呈+2价
C. 该晶体属于分子晶体,化学式为MFe2(CN)6
D. 晶体中与每个Fe3+距离最近且等距离的CN-有12个
【答案】A
【解析】
由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×![]() =
=![]() ,同样可推出含Fe3+个数也为
,同样可推出含Fe3+个数也为![]() ,CN-为12×
,CN-为12×![]() =3,因此该阴离子为[Fe2(CN)6]-,据此分析解答。
=3,因此该阴离子为[Fe2(CN)6]-,据此分析解答。
A、由题意和分析可知,该晶体属于离子晶体,阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,阳离子M的化合价为+1价,故A正确;
B、由A的分析可知,M的化合价为+1价,故B错误;
C、根据上述分析,阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,故C错误;
D、由图可看出与每个Fe3+距离最近且等距离的CN-为6个,故D错误;
答案选A。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
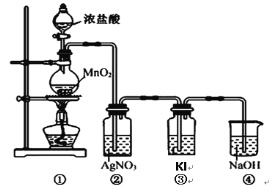
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________、_________除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________(填“能”或者“否”),请说明理由_________。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)
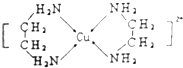
①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
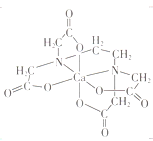
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)_______(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是______, Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用![]() Ca轰击
Ca轰击![]() Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A. 第117号元素是副族元素B. ![]() Bk的质量数为97
Bk的质量数为97
C. 第117号元素是非金属元素D. ![]() Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+离子与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于元素周期表的位置_______;
(2)G的离子结构示意图为________;
(3)用电子式表示D2的形成过程:_________;
(4)由A、E、F三种元素形成的化合物的化学式为_____,含有的化学键有____(填化学键类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
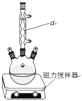
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 | ||
二苯基羟乙酮 | 212 | 133 | 344 | 1.310 | 不溶于冷水,溶于乙醇 | |
二苯基乙二酮 | 210 | 97 | 348 | 1.084 | 不溶于水,能溶于乙醇 |
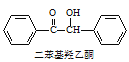 +2FeCl3
+2FeCl3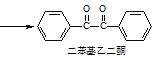 +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)装置图中仪器a的名称是____,其作用是____。
(2)加入碎瓷片的作用是____。若加热后发现未加碎瓷片,应采取的正确方法是___。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。如图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:

该实验条件下加热____后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是____。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是_____。
(7)本实验的产率是____%。(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com