
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.分析 I(1)浓硫酸具有干燥的作用;
(2)氨气与氧气反应生成NO与水,铂丝保持红热说明这个反应时放热反应,氨气溶于水形成氨水,一氧化氮会被氧气氧化生成二氧化氮,二氧化氮溶于水生产硝酸;
II.A.存在棕色的试剂瓶中,防止硝酸见光分解;
B.稀硝酸、浓硝酸都具有强的氧化性;
C.用浓硝酸与Cu反应来制备硝酸铜会释放出污染大气的二氧化氮气体;
D.金属与硝酸反应不会生成氢气;
(1)由方程式可知,溶液质量增重=NOx的质量-二氧化碳质量,由原子守恒可知n(NOx)=2n(Na2CO3)=2n(CO2),结合m=nM计算x的值;
(2)若混合气体中V(NO):V(NO2)=3:1时,应通入一定量空气,达到混合气体中V(NO):V(NO2)=1:1.
解答 解:I.(1)浓硫酸具有吸水性,可用于干燥气体,故答案为:干燥混合气体;
(2)氨气在被氧化生成NO,铂丝保持红热说明这个反应时放热反应,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气溶于水形成氨水,故溶液中会存在铵根离子,一氧化氮会被氧气氧化生成二氧化氮,二氧化氮溶于水生产硝酸,故溶液中会存在硝酸根离子,则溶液中含有的离子有NH4+和NO3-等,
故答案为:反应为放热反应;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;NH4+;NO3-;
Ⅱ.A.浓硝酸不稳定,通常保存在棕色的试剂瓶中,故A正确;
B.足量铁与稀硝酸反应后溶液呈浅绿色,是由于铁与硝酸铁反应生成硝酸亚铁,而稀硝酸、浓硝酸都具有强的氧化性,故B错误;
C.不用浓硝酸来制备硝酸铜主要是因为该反应会释放出污染大气的二氧化氮气体,与硝酸的挥发性无关,故C错误;
D.金属与硝酸反应不会生成氢气,故D错误.
故选:A;
(1)反应生成二氧化碳物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,由方程式可知,溶液质量增重=NOx的质量-二氧化碳质量,则NOx的质量=10g+0.25mol×44g/mol=21g,由原子守恒可知n(NOx)=2n(Na2CO3)=2n(CO2)=0.5mol,则0.5×(14+16x)=21,解得x=1.75,
故答案为:1.75;
(2)若混合气体中V(NO):V(NO2)=3:1时,可设NO为3mol,NO2为1mol,由题意可知一氧化氮与二氧化氮的比例关系为1:1时吸收效果最好,设一氧化氮转化成二氧化氮x摩尔,则3-x=1+x,解得x=1,由方程式2NO+O2=2NO2可知,需要0.5molO2,又空气中氧气的体积含量约为20%,则需要2.5mol空气,所以V(空气):V(NO)=2.5:3=5:6,
故答案为:5:6.
点评 本题考查化学实验、硝酸性质、氮氧化物有关计算等,Ⅱ(1)注意根据方程式判断氮的氧化物与二氧化碳物质的量关系,较好的考查学生分析计算能力,难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A. | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B. | Al粉 | Fe粉 | NaOH溶液 |
| C. | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
| D. | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成原子个数比1:1的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
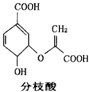
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1 mo1分枝酸最多可与3 mol NaOH发生中和反应 | |
| C. | 分枝酸的分子式为C10H8O6 | |
| D. | 分枝酸分子中含有2种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com