
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A.氯水中存在平衡Cl2+H2O?HClO+H++Cl-,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,故A不选;
B.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,故B不选;
C.增大空气的量,平衡向正反应方向移动,所以可以用平衡移动原理解释,故C不选;
D.煅烧硫铁矿利于SO2的生成,硫铁矿中含有硫元素,煅烧时生成二氧化硫,不能用平衡移动原理解释,故D选,
故选D.
点评 本题考查化学平衡移动原理,为高频考点,明确平衡移动原理内涵及适用范围是解本题关键,只有反应前后改变的物理量才能影响可逆反应的平衡移动,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为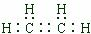 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为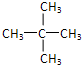 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$ $\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶 | |
| B. | 检验某卤代烃是否是氯代烃:试样$→_{煮沸}^{氢氧化钠溶液}$ 冷却 $\stackrel{稀硫酸至酸性}{→}$ $\stackrel{硝酸银溶液}{→}$出现白色沉淀 | |
| C. | 证明酸性条件H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$ $\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 除去氯化钠晶体中少量硝酸钾:试样$\stackrel{加适量水溶解}{→}$ $\stackrel{蒸发到剩少量液体}{→}$ $\stackrel{趁热过滤}{→}$ $\stackrel{洗涤晶体}{→}$再重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰中存在极性键、非极性键、范德华力、氢键 | |
| B. | MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大 | |
| C. | 等质量的金刚石晶体和石墨晶体含有的碳碳σ键数目相同 | |
| D. | 干冰的晶胞中CO2分子数目和金属铜的晶胞中Cu原子数目相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com