
族 周期 | ⅠA | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
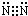 ,故答案为:
,故答案为: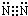 ;
;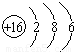 ,故答案为:
,故答案为: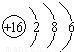 ;
;

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.

| 化学键 | F-D | F-F | B-B | F-B | C═D | D═D |
| 键能/kJ?mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||




查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省天门市高三模拟考试(一)(理综)化学部分 题型:填空题
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同的短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数1∶1或2∶1形成化合物;B、C分别能与D按原子个数1∶1或1∶2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无结晶水盐的化学式 、 。

(2)如图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 。E与D按原子个数比1∶1形成的化合物的电子式为 。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F—D |
F—F |
B—B |
F—B |
B==D |
D==D |
|
键能/ kJ·mol−1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
① 下列三种物质形成的晶体,熔点由高到低的顺序为 (用a、b、c表示)。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
② 试写出F单质晶体的燃烧的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
族 周期 |
ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com