
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |
分析 A、氢氧燃料电池是把化学能转化为电能;
B、在电镀时,要将需要溶解的金属做阳极;
C、锌活泼所以锌更容易腐蚀;
D、阳极、阴极电极反应式与正极、负极电极反应式正好相反,放电时电流从正极沿导线流向负极,据此分析解答;
解答 解:A、氢氧燃料电池是原电池是把化学能转化为电能的过程,故A错误;
B、在铁制品上镀铜时,镀层金属铜为阳极,镀件铁制品为阴极,铜盐为电镀液,故B错误;
C、锌活泼所以锌更容易腐蚀,而不是铁易腐蚀,故C错误;
D、充电时,Pb作阴极,与电源负极相连,故D正确;
故选D.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,再结合各个电极上发生的反应来确定金属被保护还是被腐蚀,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 属于金属元素 | B. | 中子数与质子数之差为29 | ||
| C. | 原子的核外电子数为13 | D. | 27Al和42Al是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的加成反应和乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关 | |
| B. | 相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜片插入FeCl3溶液中:Cu+2Fe3+═Cu2++2 Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 烧碱溶液中加铝片:2Al+2OH-+2H2O═2 AlO2-+3H2↑ | |
| D. | 铁粉与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K值不变,平衡一定不移动 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值一定变化 | D. | 平衡移动,K值一定不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
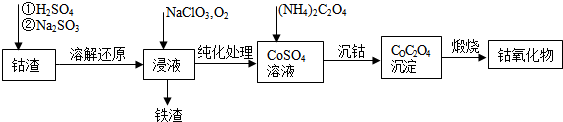
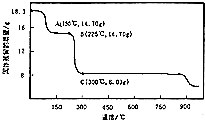
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com