
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成分是SiO2
D.电解熔融MgCl2,可制得金属镁
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为:
以下合成路线是某化工厂生产流程的一部分:

已知:
请回答下列问题:
(1)写出F中官能团的名称 。
(2)写出D的名称(系统命名) 。
(3)④的反应类型是 ;B的结构简式是 。
(4)写出反应⑥的化学方程式为 。
(5)已知H与D互为同分异构体, H属于炔烃,其核磁共振氢谱有3种吸收峰,则H的结构简式为: (任写一种)。
(6)有关C的说法正确的是
a.能使溴的四氯化碳溶液褪色 b.能和氢氧化钠溶液反应
c.能使酸性高锰酸钾褪色 d.能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。

(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______________微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酯化反应说法正确的是( )
A.用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B.反应液混合时,顺序为先倒乙醇再倒浓硫酸最后倒乙酸
C.乙酸乙酯不会和水生成乙酸和乙醇
D.用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
A.x =1
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
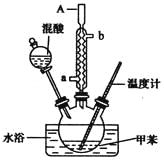
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
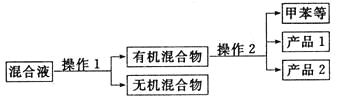
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为生活中用途最广泛的金属单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
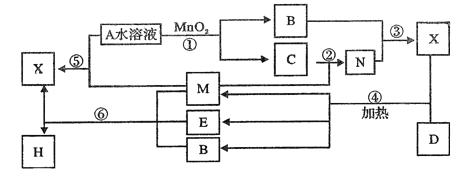
(1)A的结构式_________________,E的化学式为______________。
(2)在①至⑥的化学反应中,属于非氧化还原反应的化合反应为(填序号)__________________。
(3)写出下列反应的化学方程式②_______________,④________________。
(4)写出⑥的离子方程式:_____________________。
(5)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,所得沉淀经过滤、洗涤、灼烧至恒重,称量所得固体的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切关系,下列说法错误的是( )
A.燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放
B.洪涝灾害地区的灾民用明矾和漂白粉先后处理浊水后就可直接饮用
C.人们所使用的材料,不一定是纯度越高越好
D. 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
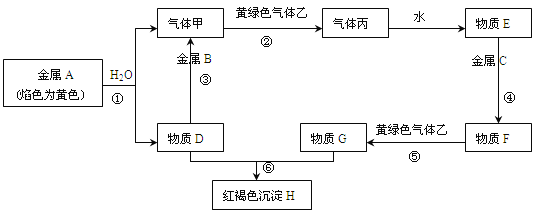
请回答下列问题:
写出下列物质的化学式:C 、G 、丙 。
写出下列反应的离子方程式:
反应① ;
反应④ ;
反应⑤ ;
反应⑥ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com