
| A. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 金属元素只有正价和零价,而非金属元素既有正价又有负价又有零价 |
分析 A.非金属元素呈现的最低化合价为原子最外层电子数-8;
B.非金属元素呈现的最高化合价等于原子最外层电子数;
C.He最外层电子数为2;
D.氟无正价,只有负价和零价.
解答 解:A.非金属元素呈现的最低化合价为原子最外层电子数-8,最高化合价等于原子最外层电子数,故A错误;
B.非金属元素呈现的最高化合价等于原子最外层电子数,不超过该元素原子的最外层电子数,故B正确;
C.He最外层电子数为2,为非金属元素,故C错误;
D.氟无正价,只有负价和零价,所以并不是所有非金属都有正价,故D错误;
故选B.
点评 本题考查原子的结构与元素周期表的结构,题目难度不大,注意元素周期表的组成特点.


科目:高中化学 来源: 题型:选择题
| A. | 02是氧化剂,PtF6是还原剂 | |
| B. | 02 (PtF6)中氧元素的化合价为+1 | |
| C. | 02( PtF6)中不存在共价键 | |
| D. | 每生成1 mol O2 (PtF6)则转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
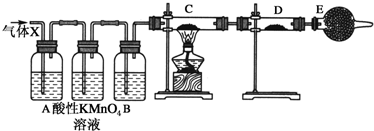
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 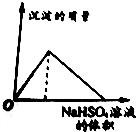 | B. | 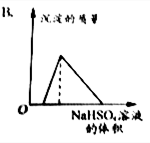 | ||
| C. |  | D. | 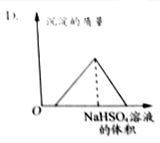 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com