


 .
. 分析 A的产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇与高锰酸钾发生氧化生成C为CH3COOH,乙醇与乙酸发生酯化反应生成D为CH3COOCH2CH3,CH3COOCH2CH3与乙醇钠发生信息②的反应生成E为 ,据此解答.
,据此解答.
解答 解:A的产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇与高锰酸钾发生氧化生成C为CH3COOH,乙醇与乙酸发生酯化反应生成D为CH3COOCH2CH3,CH3COOCH2CH3与乙醇钠发生信息②的反应生成E为 ,
,
(1)A为CH2=CH2,A中氢的质量分数为$\frac{4}{28}$×100%=14.3%,
故答案为:14.3%;
(2)由上面的分析可知,B、C的结构简式依次为CH3CH2OH、CH3COOH,
故答案为:CH3CH2OH、CH3COOH;
(3)反应C→D的化学方程式为CH3CH2OH+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应D→E的化学方程式为 ,
,
故答案为:CH3CH2OH+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O; .
.
点评 本题考查有机物的推断,中等难度,涉及烯烃、醇、醛、羧酸、酯的性质与转化,注意基础知识的掌握和题中信息的灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用于制作半导体材料 | B. | 碳酸钠可用于制胃酸中和剂 | ||
| C. | 氧化铁可用于制作红色涂料 | D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和足量稀硝酸反应:Fe+2H+═H2↑+Fe2+ | |
| B. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 稀硫酸与氢氧化钡溶液反应:Ba2++S042-═BaS04↓ | |
| D. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:
A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3-CH2-CH2-CH2-OH | ||
| C. | CH2=CHCl | D. | 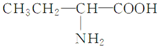 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com