
| A. | 微量元素缺少或者摄入过多,都可能导致患各种代谢疾病 | |
| B. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 | |
| C. | 人体缺钙,可以多喝硬水补钙 | |
| D. | 缺铁性贫血,可通过食用铁强化酱油预防 |
分析 细胞中常见的化学元素有20多种,其中C、H、O、N、P、S、K、Ca、Mg等称为大量元素,Fe、Mn、Zn、Cu、B、Mo等被称为微量元素,元素的分类是从含量上划分的,不是从作用上,微量元素的作用也非常重要,以此解答该题.
解答 解:A.微量元素含量不多,但作用非常重要,缺少后会引起相应的病症,如过量,可导致中毒等,故A正确;
B.锌影响身体发育,儿童缺锌可导致生长发育不良,抵抗力差,食欲不振,故B正确;
C.硬水中的钙不能被吸收,故C错误;
D.铁强化酱油可以为人体补铁,所以缺铁性贫血,可通过食用铁强化酱油预防,故D正确.
故选C.
点评 本题考查微量元素与人体健康,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在任何溶液中,若有CaSO4沉淀析出,则c(Ca2+)与c(SO42-)一定相等 | |
| B. | d点溶液通过蒸发可以变到c点 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
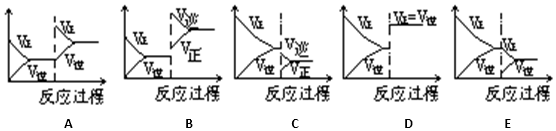
| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
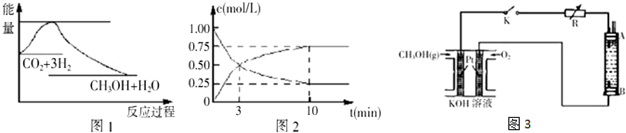
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | 2min时Y的物质的量为0.14 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小 | |
| D. | 2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com