
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥ ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
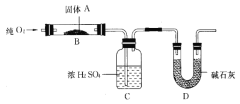
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
【答案】① nCH2=CH2→![]() ③
③ 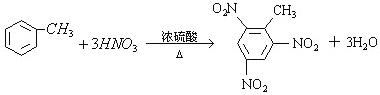 ②④⑥ ⑦
②④⑥ ⑦ ![]() 吸收A燃烧后生成的CO2 D能够吸收空气中的二氧化碳和水蒸气,造成实验误差 C12H22O11
吸收A燃烧后生成的CO2 D能够吸收空气中的二氧化碳和水蒸气,造成实验误差 C12H22O11
【解析】
(一)(1)乙烯的产量是衡量一个国家的石油化工生产水平的标志,故选①;乙烯能够发生加聚反应生成聚乙烯,反应的方程式为nCH2=CH2→![]() ,故答案为:①;nCH2=CH2→
,故答案为:①;nCH2=CH2→![]() ;
;
(2)能用来制取梯恩梯(TNT)的是甲苯,故选③,发生反应的化学方程式为 ,故答案为:③;
,故答案为:③; ;
;
(3)能与金属钠发生反应的有机物需要含有羟基或羧基,②2-丙醇、④![]() 、⑥
、⑥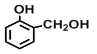 能与金属钠发生反应,故选②④⑥;⑧
能与金属钠发生反应,故选②④⑥;⑧![]() 的分子式为C8H8,与⑧互为同分异构体的是⑦苯乙烯,故选⑦;⑤
的分子式为C8H8,与⑧互为同分异构体的是⑦苯乙烯,故选⑦;⑤![]() 中的甲基能够被酸性高锰酸钾氧化为羧基,反应的产物是
中的甲基能够被酸性高锰酸钾氧化为羧基,反应的产物是![]() ,故答案为:②④⑥;⑦;
,故答案为:②④⑥;⑦;![]() ;
;
(二)(4)D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;外界空气中也含有二氧化碳和水蒸气,能够被碱石灰稀释,造成实验误差,可以在D后面接一个盛有碱石灰的干燥管,故答案为:吸收A燃烧后生成的CO2;D能够吸收空气中的二氧化碳和水蒸气,造成实验误差;
(5)浓硫酸增重可知水的质量为9.9g,可计算出n(H2O)=![]() =0.55mol,n(H)=1.1mol,m(H)=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.55mol,n(H)=1.1mol,m(H)=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=![]() =0.6mol,m(C)=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为8.8g,n(O)=
=0.6mol,m(C)=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为8.8g,n(O)=![]() =0.55mol,n(C)∶n(H)∶n(O)=0.6mol∶1.1mol∶0.55mol=12∶22∶11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式为C12H22O11,故答案为:C12H22O11。
=0.55mol,n(C)∶n(H)∶n(O)=0.6mol∶1.1mol∶0.55mol=12∶22∶11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式为C12H22O11,故答案为:C12H22O11。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3B.Ba(NO3)2C.Na2SO4D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,4.48 L的NH3气体物质的量为________mol质量为________g,其中含________个氢原子(用NA表示),将其溶于水配成200 mL的溶液,其物质的量浓度为________mol/L,若将标准状况下,4.48 L的NH3气体与0.3 mol的CH4混合,相同条件下,该混合气体对H2的相对密度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在KCl和CaCl2 所组成的某混合物中,K+ 与Ca2+ 的物质的量之比为1∶2,则该混合物中含CaCl2的质量分数为 _______,含1molCl- 的该混合物的质量是____________g。
(2)在标准状况下,由CO 和CO2 组成的混合气体13.44L,质量为20g,该混合气体中,碳与氧两种原子的数目之比为 ____________________。
(3)在某未知体积的NaOH溶液中,经测定含有6.02×1023个OH—,则OH—的物质的量为_______,此溶液中溶质的质量为_______.。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物 B. b和c都能与新制Cu(OH)2溶液反应
C. a、b和c均能使酸性KMnO4溶液褪色 D. b和c互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
A. K1和K2的单位均为mol/L B. K1 < K2
C. C2(CO) = C2(H2O) D. C1(CO) > C2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下图所示装置(I)制取溴苯和溴乙烷。已:溴乙烷为无色液体,难溶于水,沸点38.4℃,熔点一119℃,密度为1.64g·cm-3。主要实验步骤如下:

①检查气密性后,向烧瓶中加入一定量苯和液溴。
②向锥型瓶中加入乙醇和浓H2SO4的混合液至恰好没过进气导管口。
③将A装置中纯铁丝小心向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10分钟。
请填写下列空白:
(1)A装置中发生的反应的化学方程式________________________________
(2)导管a的作用是_______________。
(3)C装置中U型管的内部用蒸馏水封住管底的作用是___________________________。
(4)反应完毕后,分离出溴乙烷时所用最主要仪器名称是(只填一种)_____________。
(5)步骤④中可否用大火加热,理由是____________________________________。
(6)为证明溴和苯的上述反应是取代而不是加成反应。该学生用装置(Ⅱ)代替装置B、C直接与A相连接重新反应,锥形瓶里盛放的液体为AgNO3溶液。
①装置(Ⅱ)的锥形瓶中小试管内的液体是____________(填名称),其作用为_______________
②能证明溴和苯的反应是取代反应的现象为_________________________;装置(Ⅱ)还可起到的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com