
| A. | c(S2-)+c(HS-)+c(H2S)+c(H+)=c(OH-) | B. | c(OH-)=c(HS-)+c(H+)+2 c(H2S) | ||
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S) | D. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
分析 A.硫离子的水解程度较小,则c(S2-)>>c(OH-);
B.根据溶液中的质子守恒判断;
C.根据硫化钠溶液中的物料守恒分析;
D.根据硫化钠溶液中的电荷守恒判断.
解答 解:A.硫化钠水溶液中,由于硫离子水解程度较小,则c(S2-)>>c(OH-),则c(S2-)+c(HS-)+c(H2S)+c(H+)>>c(OH-),故A错误;
B.硫化钠水溶液中存在质子守恒,水电离出的氢离子和氢氧根离子浓度应相同,则:c(OH-)=c(HS-)+c(H+)+2 c(H2S),故B正确;
C.硫化钠水溶液中存在物料守恒,钠元素和硫元素物质的量之比为2:1,溶液中物料守恒为:c(Na+)=2 c(S2-)+2 c(HS-)+2 c(H2S),故C错误;
D.硫化钠水溶液中存在电荷守恒,阳离子所带正电荷的浓度和等于阴离子所带的负电荷的浓度和:c(Na+)+c(H+)=2 c(S2-)+c(HS-)+c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,注意明确电解质溶液中质子守恒、物料守恒和电荷守恒的含义,熟练掌握盐的水解原理、电荷守恒、物料守恒、质子守恒在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ | |
| B. | 将10g碳酸钙粉末加水配制成100mL溶液,CaCO3的物质的量浓度为1mol/L | |
| C. | 通入标准状况下11.2LHCl气体,可使1L 0.5mol/L的盐酸的物质的量浓度增大一倍 | |
| D. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数$\frac{20}{20+9a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
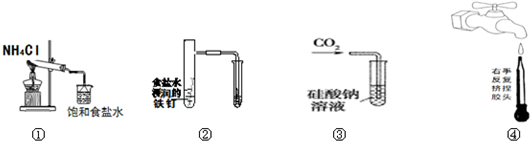
| A. | 实验①制取的氨气溶解在饱和NaCl溶液 | |
| B. | 实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 | |
| C. | 实验③可用于证明碳的非金属性比硅强 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>③>②>① | B. | ④<③=②<① | C. | ①>②>③>④ | D. | ④>③=②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ1<ρ2 | B. | ρ1=ρ2 | C. | ρ1>ρ2 | D. | 无法估算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯分子数为NA | |
| B. | 1mol•L-1FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 25℃,1.01×105Pa,14g乙烯所含的碳原子数为NA | |
| D. | 1molNa2SO4溶于水,所得溶液中Na+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则二者的化学性质相同 | |
| C. | Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | Fe3+、Na+、C1-、NO3- | ||
| C. | K+、NH4+、Cl-、AlO2- | D. | Cu2+、NH4+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com