
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0 | |
| B. | 用pH均为12的NaOH溶液和氨水分别中和等物质的量的HCl,消耗氨水的v更大 | |
| C. | N2(g)+3H2(g)?2NH3(g) (△H<0),当其他条件不变时,升高温度,H2的反应速率增大、转化率减小 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
分析 A.MgCl2(1)═Mg(1)+Cl2(g)该反应为吸热、熵值增大的反应;
B.pH=12的NaOH溶液和氨水,氨水的浓度大,所以中和物质的量的HCl,消耗氨水的体积小;
C.升高温度平衡向吸热方向移动;
D.平衡常数只受温度影响.
解答 解:A.MgCl2(1)═Mg(1)+Cl2(g)该反应为吸热、熵值增大的反应,即MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0,故A正确;
B.pH=12的NaOH溶液和氨水,氨水的浓度大,所以中和物质的量的HCl,消耗氨水的体积小,故B错误;
C.N2(g)+3H2(g)?2NH3(g) (△H<0),反应为放热反应,升高温度,平衡向左移动,氢气转化率降低,故C正确;
D.平衡常数只受温度影响,温度不变,平衡常数不变,故D错误;
故选:AC.
点评 本题为综合题,考查了焓变与熵变、化学平衡的移动的影响因素、弱电解质的电离,掌握基础是解题关键,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | CH≡CH和CH2=CHCH=CH2互为同系物 | |
| C. | 乙酸乙酯在碱性条件下的水解反应皂化反应 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
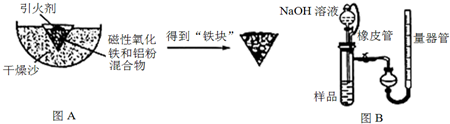
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量潮湿的CO2反应,转移的电子数为0.1 NA | |
| B. | 标准状况下2.24 L HCHO中含0.4 NA个原子 | |
| C. | 23.4g NaCl晶体中含0.1 NA个如图所示结构单元 | |
| D. | 4.0gSiC晶体中含有的共价键数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3可溶,NaHCO3难溶 | |
| B. | 可用Ca(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 | |
| C. | Na2CO3中的NaHCO3可通过加热的方法除去 | |
| D. | Na2CO3不能转化成与NaHCO3,而NaHCO3能转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
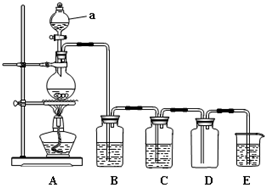 如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:
如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCL+H2O | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na+Cl2═2NaCl | D. | AgNO3+KBr═AgBr↓+KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g水所含有的电子数目为NA | |
| B. | 等物质的量的CaCO3和KHCO3的质量均为100g | |
| C. | 11.2L氧气所含分子数目为0.5NA | |
| D. | 200mL 0.5mol/L Na2SO4溶液所含Na+数目0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com