
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( ![]() )、苯甲酸(
)、苯甲酸( ![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点 (0C) | 沸点 (0C) | 相对密度 ( | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
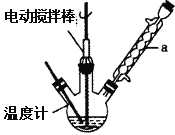
(1)装置a的名称是__________________,主要作用是____________________。
(2)三颈瓶中发生反应的化学方程式为______________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是______________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。【苯甲酸相对分子质量:122.0】
【答案】 球形冷凝管冷凝回流 防止甲苯的挥发而降低产品产率 ![]() H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量 过滤 蒸馏 dacb 87.84﹪
H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量 过滤 蒸馏 dacb 87.84﹪
【解析】(1)仪器a具有球形特征的冷凝管,名称为为球形冷凝管,甲苯挥发会导致产率降低,冷凝回流,防止甲苯挥发导致产率降低,故答案为:球形冷凝管;冷凝回流,防止甲苯的挥发而降低产品产率;
(2)三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水,反应方程式为:![]() , 故答案为:
, 故答案为: ![]() ;
;
(3)但温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,苯甲醛的产量却有所减少,故答案为:温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量;
(4)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸,故答案为:过滤、蒸馏;
(5)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸,再洗涤、干燥得到苯甲酸,故正确的操作步骤是:dacb,故答案为:dacb;
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.50g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。苯甲酸的物质的量等于消耗KOH物质的量,则2.500g产品中苯甲酸为0.018L×0.1mol/L×![]() ×122g/mol=2.196g,产品中苯甲酸的质量分数为
×122g/mol=2.196g,产品中苯甲酸的质量分数为![]() ×100%=87.84%,故答案为:87.84%。
×100%=87.84%,故答案为:87.84%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________
(2)火箭中的主要燃料是“肼(也称为联氨)”的液体物质。此化合物的相对分子质量为32。其中,含N的质量分数为87.5%,其余为H元素。则:
①肼的化学式为__________________,其结构式为_____________________________
②此燃料的氧化剂是N2O4气体,若燃烧0.2 mol肼液体放出的热量为 400 kJ,燃烧的产物对大气都无污染(生成的水为液态),则肼与N2O4气体反应的热化学方程式为:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的△H<0
D. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A. SO2能杀菌、消毒,可用做食品防腐剂
B. NH4HCO3受热易分解,可用作氮肥
C. 明矾溶于水产生的硫酸根离子有氧化性,可用于净水
D. 常温下铁和浓硝酸不反应,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 纯碱 | 硫酸 | 小苏打 | 氧化铝 | 干冰 |
B | 苛性钠 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
C | 熟石灰 | 冰醋酸(CH3COOH) | 胆矾CuSO4·5H2O | 三氧化硫 | 二氧化硫 |
D | 苛性钾 | HNO3 | 碳酸钙 | 生石灰 | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:

请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式_______________________。
(2)将酸浸的尾气循环利用,加入的X气体可以是____________________________。
(3)流程中加入ZnO调pH的目的是__________________________________________。
(4)滤渣2中的成分是___________________。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol/L,则溶液中S2-浓度大于______mol/L,才生成ZnS沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质组合中,既能和酸反应又能和碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3
A. ①②③④ B. ②③④ C. ①③④ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com