
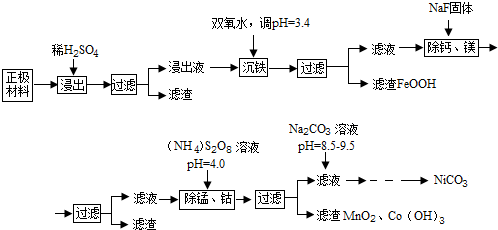
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
分析 镍氢电池是正极主要为氢氧化镍[Ni(OH)2],其表面覆盖有钴或氢氧化钴[Co(OH)2],还含有Fe、Mn、Ca、Mg等杂质元素,加稀硫酸溶解、过滤,滤液中含有Ni2+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+,加双氧水,同时调节pH=3.4,亚铁离子转化为沉淀FeOOH析出,过滤,滤液中含有Ni2+、Co2+、Mn2+、Ca2+、Mg2+,在滤液中加NaF固体,Ca2+和Mg2+转化为沉淀CaF2、MgF2,过滤,滤液中含有Ni2+、Co2+、Mn2+,在滤液中加过硫酸铵[(NH)2S2O8],把Co2+氧化为Co3+,把Mn2+氧化为MnO4-,MnO4-继续与Mn2-反应生成MnO2沉淀,调节pH=4.0,Co3+转化为Co(OH)3沉淀,过滤,在滤液中加碳酸钠生成NiCO3沉淀,过滤、洗涤、干燥,得到纯净的NiCO3;
(1)酸性条件下,亚铁离子被双氧水氧化生成FeOOH和H+;
(2)若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,根据c(F-)=$\sqrt{\frac{{K}_{sp}}{c({R}^{2+})}}$计算氟离子的最小浓度;
(3)根据得失电子守恒和原子守恒配平方程式,再计算氧化剂和还原剂的物质的量之比;MnO4-可与Mn2+反应生成MnO2,结合元素守恒和电子守恒配平方程式;根据表格中Mn2+和Co2+浓度求出质量和物质的量,再根据二者与(NH)2S2O8反应的方程式计算;
(4)溶液pH较大时Ni2+会形成Ni(OH)2沉淀析出;
(5)从浑浊液中得到纯净的固体需要过滤、洗涤、干燥.
解答 解:镍氢电池是正极主要为氢氧化镍[Ni(OH)2],其表面覆盖有钴或氢氧化钴[Co(OH)2],还含有Fe、Mn、Ca、Mg等杂质元素,加稀硫酸溶解、过滤,滤液中含有Ni2+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+,加双氧水,同时调节pH=3.4,亚铁离子转化为沉淀FeOOH析出,过滤,滤液中含有Ni2+、Co2+、Mn2+、Ca2+、Mg2+,在滤液中加NaF固体,Ca2+和Mg2+转化为沉淀CaF2、MgF2,过滤,滤液中含有Ni2+、Co2+、Mn2+,在滤液中加过硫酸铵[(NH)2S2O8],把Co2+氧化为Co3+,把Mn2+氧化为MnO4-,MnO4-继续与Mn2-反应生成MnO2沉淀,调节pH=4.0,Co3+转化为Co(OH)3沉淀,过滤,在滤液中加碳酸钠生成NiCO3沉淀,过滤、洗涤、干燥,得到纯净的NiCO3;
(1)酸性条件下,亚铁离子被双氧水氧化生成FeOOH和H+,其反应的离子方程式为:2Fe2++H2O2+2H2O=2FeOOH+4H+;
故答案为:2Fe2++H2O2+2H2O=2FeOOH+4H+;
(2)已知Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.5×10-9,CaF2的溶度积比MgF2小,CaF2先沉淀,当MgF2完全沉淀(即浓度小于1.0×10-5mol/L)时,CaF2也一定完全沉淀,当溶液中Mg2+浓度等于1.0×10-5mol/L时,c(F-)=$\sqrt{\frac{{K}_{sp}(Mg{F}_{2})}{c(M{g}^{2+})}}$=$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$,所以若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F-浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$;
故答案为:$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$;
(3)该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以S元素得电子化合价降低,S2O82-作氧化剂,S元素化合价变化为+7价→+6价,则该方程式为8H2O+5S2O82-+2Mn2+=2MnO4-+10SO42-+16H+,所以氧化剂和还原剂的物质的量之比为5:2;
MnO4-可与Mn2+反应生成MnO2,其离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2↓+4H+;
1L浸出液中的Mn2+为0.22g,Co2+为5.90g,Co2+与S2O82-的反应方程式为S2O82-+2Co2+=2SO42-+2Co3+,
则5(NH)2S2O8~~~2Mn2+ (NH)2S2O8~~~~~~2Co2+;
5×228 2×55 228 2×59
m 0.22g m′5.9g
则过硫酸铵的质量=m+m′=$\frac{5×228×0.22g}{2×55}$+$\frac{228×5.9g}{2×59}$=13.68g;
故答案为:5:2;3Mn2++2MnO4-+2H2O=5MnO2↓+4H+;13.68;
(4)已知Ksp[Ni(OH)2]=5.5×10-16,当溶液pH较大时Ni2+会形成Ni(OH)2沉淀析出,使产品的回收率降低;
故答案为:Ni2+也会形成Ni(OH)2沉淀析出;
(5)加入Na2CO3溶液后,Ni2+转化为NiCO3沉淀,要从该浑浊液中得到纯净的固体需要过滤、洗涤、干燥,
故答案为:过滤、洗涤、干燥.
点评 本题考查了物质的分离提纯的方法和基本操作综合,题目涉及物质的分离、离子方程式的书写、Ksp的有关计算、氧化还原反应的计算等,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )| A. | a为负极,是铁片,烧杯中的溶液为稀硫酸溶液 | |
| B. | b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 | |
| C. | a为正极,是碳棒,烧杯中的溶液为稀硫酸溶液 | |
| D. | b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②④ | B. | ②④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 | B. | 0.20 | C. | 0.30 | D. | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
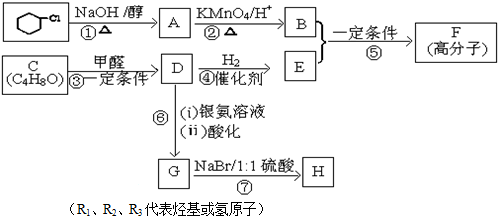
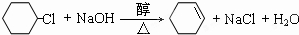 .
.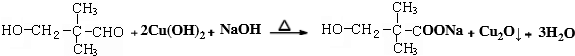
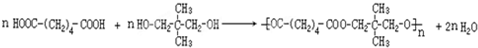 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com