
A,B,C,D,E5种元素,已知
(a)A原子最外层电子数是次外层电子数的两倍。B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子M层上的电子比K层多5个。
(b)常温下B2是气体,它对氢气的相对密度是16。
(c)C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
(d)D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)A是________,B是________,C是________,D是________,E是________(写元素符号);
(2)E的原子结构示意图________,C的离子结构示意图________;
(3)F和AB2反应的化学方程式________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 0.1mol/L的Ba(OH)2溶液的体积/mL | 10 | 10 | 10 | 10 | 10 |
| 0.1mol/L的E溶液的体积/mL | 5 | 10 | 15 | 20 | 25 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期第三次月考化学试卷 题型:填空题
(11分)短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
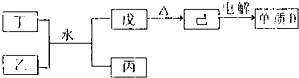
(1)已知相关物质之间存在如下变化:
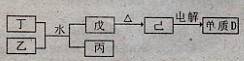
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
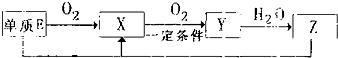
(2)已知E及其化合物有以下变化:
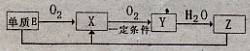
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三高考仿真训练题(理综)化学部分 题型:填空题
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:

①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质己电解得到单质D的化学方程式为 ;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为 ;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至 。
(2)已知E及其化合物有以下变化:
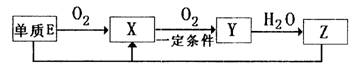
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式___ _,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为 (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省高一下学期期末考试化学试题 题型:填空题
(12分)有A、B、C、D、E5种元素,已知:
①A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
②常温下B2是气体,相同条件下,它的密度是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1)D是 ,其在周期表中的位置为 。
(2)E的原子结构示意图为 ,C的离子结构示意图为 。
(3)F和AB2反应的化学方程式为 。
(4)F中含有的化学键为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com