
下列叙述正确的是
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)  2HI(g)不移动,体系颜色不变
2HI(g)不移动,体系颜色不变
②常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
A.全错 B.只有④正确 C.①③④正确 D. ①②③正确
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列事实可以证明亚硝酸是弱酸的是( )
① 0. 1 mol/L HNO2溶液的pH=2;
1 mol/L HNO2溶液的pH=2;
② HNO2溶液不与Na2SO4溶液反应;
③ HNO2溶液的导电性比盐酸弱;
④ 25℃时NaNO2溶液的pH大于7;
⑤ 将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7
A.①③④ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期元素。其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3∶4。下列说法中正确的是( )
A. 原子半径:W>Z>Y>X B. 氢化物稳定性:Y>Z
C. WY3中只有离子键没有共价键 D. YX3可用于检验Cl2泄漏
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-个数比为1∶2∶5,欲使这些离子个数比为5∶2∶1,那么要通入Cl2分子个数与原溶液中I-个数比应为( )
A.1∶2 B.2∶1 C.2∶5 D.5∶2
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)H﹣H、O = O和O﹣H键的键能分别为: a kJ/mol、b kJ/mol和c kJ/mol。CH3OH(g)的燃烧热为△H=—d kJ/mol。则CO2(g)+3H2(g) = CH3OH(g)+ H2O(l) △H= kJ•mol﹣1。(用含a、b、c、d的代数式表示)
(2)将CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的△H 0(填“>”或“<”)。若温度不变,减小反应投料比,K值将 (填“增大”、“减小”或“不变”)。
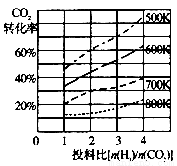
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生反应制备二甲醚,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。(填字母,多选)
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
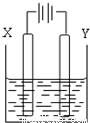
(4)以二甲醚、空气、KOH溶液组成的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,如图所示,请写出该燃料电池负极反应式 。当燃料电池消耗2.8LO2(标况)时,NaCl溶液的pH= (溶液体积变化忽略)(常温)。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:选择题
下列表述正确的是
A.0.1 mol/L的(NH4)2SO4溶液:c(SO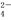 )>c(NH
)>c(NH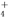 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO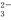 )
)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液:
2c(H+)+ c(CH3COOH) = c(CH3COO- ) +2c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:选择题
下列说法中正确的是
A.相同温度下,同浓度的溶液的pH:CH3COONa > Na2CO3 > NaHCO3 > NaClO
B.同温同浓度的三种溶液:①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2FeSO4 c (NH4+)大小:②>①>③
C.室温时pH=8的NaOH溶液与pH=8的氨水等体积混合pH等于8
D.向1mL0.1mol/L AgNO3溶液中滴加3~5滴0.1mol/L NaCl溶液,产生白色沉淀,再滴入KI
溶液,沉淀变成黄色,由此推出:Ksp(AgI) < Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:选择题
下列有关原电池的说法中不正确的是
A.由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动
B.由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-= AlO2-+2H2O
C.由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g
D.由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:实验题
“碘钟”实验中,3I-+S2O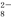 ===I
===I +2SO
+2SO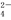 的反应速率可
的反应速率可 以用I
以用I 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O | 0.040 | 0.040 | 0.060 | 0.020[ | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是:___________________。
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=____________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
a.<22.0 s b.22.0~44.0 s c.>44.0 s d.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com