
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
分析 A、氧气和臭氧均由氧原子构成;
B、氯气和水的反应为可逆反应;
C、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$;
D、求出钠的物质的量,然后根据反应后钠元素为+1价来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故为2NA个,故A正确;
B、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故B错误;
C、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{11.2L}{22.4L/mol}{N}_{A}/mol$=0.5NA个,故C正确;
D、23g钠的物质的量为1mol,而反应后钠元素为+1价,故1mol转移1mol电子即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
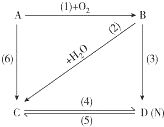 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10ml | B. | 30ml | C. | 50ml | D. | 70ml |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
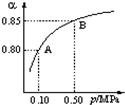
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.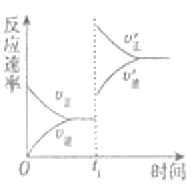
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com