
| A. | 放电时,负极上Fe发生还原反应 | |
| B. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 | |
| C. | 放电时,Ni(OH)2是还原产物 | |
| D. | 该蓄电池放电过程和充电过程发生的是可逆反应 |
分析 由总反应式Fe+NiO2+2H2O $?_{充电}^{放电}$Fe(OH)2+Ni(OH)2可知,根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应.
解答 解:A.放电时,Fe元素化合价升高,被氧化,应为原电池负极,发生氧化反应,故A错误;
B.此电池为碱性电池,反应方程式时不能出现H+,放电时,正极反应是NiO2+2e-+2H2O=Ni(OH)2+2OH-,故B错误;
C.放电时,Ni(OH)2中Ni化合价由+4价降低到+2价,为还原产物,故C正确;
D.由于放电与充电过程的条件不同,故不是可逆反应,故D错误.
故选:C.
点评 本题考查原电池和电解池的工作原理,题目难度中等,注意电解反应式的书写,为解答该题的关键,答题时注意体会.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
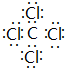 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、HCO3- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | MnO4-、K+、S2-、H+ | D. | Mg2+、Cl-、NO${\;}_{3}^{-}$、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨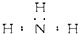 | |
| B. | 四氯化碳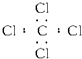 | |
| C. | 氮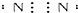 | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com