
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
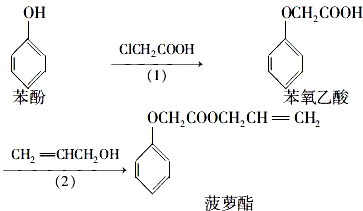
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与KMnO4酸性溶液发生反应 | |
| C. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| D. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯的一溴代物无同分异构体 | |
| B. | 苯的间二溴代物无同分异构体 | |
| C. | 苯的对二溴代物无同分异构体 | |
| D. | 苯不能使溴水或酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g | |
| B. | 1molC5H12分子中碳碳之间共用的电子对数为5NA | |
| C. | 电解Na2SO4溶液,在阴极区增加2molH+ 时消耗电子数为2NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,放出46kJ热量转移电子数3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
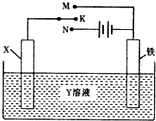
| A. | 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法 | |
| B. | 若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变 | |
| C. | 若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小 | |
| D. | 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com