
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
分析 135℃,101.3kPa时水为气体,设烃为CxHy,由CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用气体体积差量确定y值,然后结合a=8L时1.5(x+$\frac{y}{4}$)≤10,据此确定该烃的分子式.
解答 解:135℃,101.3kPa时水为气体,设烃为CxHy,
则:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O 气体体积差量△V
1 (x+$\frac{y}{2}$-x-$\frac{y}{4}$-1)
1.5L (a+3-a-1.5)L
解得:y=8;
即该烃的分子式满足:CxH8,
若a=8时,由于该烃完全燃烧,则:1.5(x+$\frac{y}{4}$)≤10,解得:x≤$\frac{14}{3}$,x可能为3或4,
则该烃的分子式可能为:C4H8或C3H8,
故选C.
点评 本题考查了有机物分子式确定的计算,题目难度中等,先根据差量法确定该烃分子中含有H原子数为解答关键,注意掌握差量法、讨论法在化学计算中的应用,试题培养了学生的化学计算能力.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
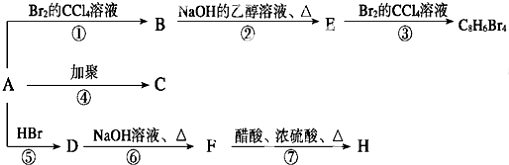
 .
. ;E:
;E: .
.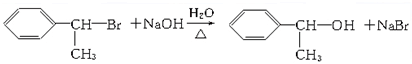 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
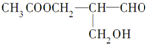 )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与氢气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
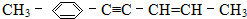 ,共面的碳原子最多有
,共面的碳原子最多有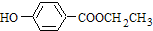 ;
;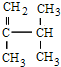 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com