
| A. |  证明装置的气密性良好 | |
| B. | 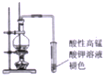 证明乙醇与浓H2SO4共热生成了大量乙烯 | |
| C. | 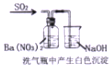 证明SO2有还原性 | |
| D. |  用饱和食盐水与CaC2制备并收集C2H2 |
分析 A.利用液差法检验气密性;
B.乙醇与浓H2SO4共热发生消去反应生成乙烯,乙醇易挥发,均能被高锰酸钾氧化;
C.白色沉淀为硫酸钡;
D.饱和食盐水与CaC2反应生成乙炔,且乙炔不溶于水.
解答 解:A.关闭止水夹,当长颈漏斗中液面高于烧瓶中液面,且一段时间不变,则气密性良好,故A正确;
B.乙醇与浓H2SO4共热发生消去反应生成乙烯,乙醇易挥发,均能被高锰酸钾氧化,应除去乙醇的干扰,故B错误;
C.白色沉淀为硫酸钡,可知二氧化硫与硝酸根离子发生氧化还原反应生成硫酸根离子,证明SO2有还原性,故C正确;
D.饱和食盐水与CaC2反应生成乙炔,且乙炔不溶于水,则图中装置可制备并收集C2H2,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及气密性检验、有机物的制备及检验、氧化还原反应等,把握物质的性质及化学反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减少13g | |
| D. | 电池工作时,电子由负极通过外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①组物质都不能使酸性高锰酸钾褪色,②组物质都能使酸性高锰酸钾褪色 | |
| B. | ①组物质都不能使溴的四氯化碳褪色,②组物质都能使溴的四氯化碳褪色 | |
| C. | ②组物质所有原子可以在同一平面内 | |
| D. | 邻二甲苯的一氯代物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
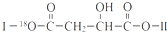 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.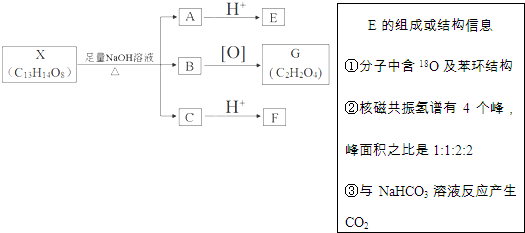
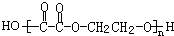 +(2n-1)H2O
+(2n-1)H2O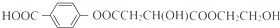 +4NaOH$→_{△}^{水}$
+4NaOH$→_{△}^{水}$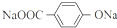 +NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O
+NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O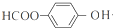 等
等查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
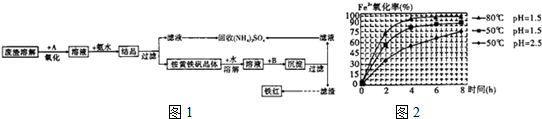 -
-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com