

| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
分析 I、(1)海水中的弱酸根离子水解显碱性;
(2)H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+);
Ⅱ、(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$进行计算.
解答 解:I、(1)天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
(2)H2SO3中的S显+4价,均可被O2氧化生成H2SO4,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=2H2SO4;中和、稀释经氧气氧化后海水中生成的酸(H+);
Ⅱ、(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=11.0,c(OH-)=10-3mol•L-1,则c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-15}}{(1{0}^{-3})^{2}}$=1.2×10-9mol•L-1,
故答案为:1.2×10-9mol•L-1 .
点评 本题考查了含硫烟气的处理及难溶物的沉淀转化,利用所学知识结合框图信息是解答本题的关键,难度中等,注意把握Ksp的有关计算的方法.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 压强为原来的两倍 | B. | 平衡向右移动,混合气体颜色变浅 | ||
| C. | 压强增大,但小于原来的两倍 | D. | 平衡向右移动,混合气体密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若升高温度,X(g)的浓度增大,则正反应为吸热反应 | |
| B. | 若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| C. | 压强变化对该平衡没有影响 | |
| D. | 若容器体积不变,加入氦气平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯可发生加成反应 | |
| B. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| C. | 乙烯和苯都能与溴水反应 | |
| D. | 乙烯和乙烷都能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
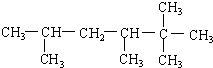 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷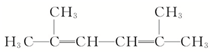 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com