
| A. | H-OH | B. | CH3OH | C. | 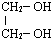 | D. | CH3OCH3 |
分析 结构相似,在分子组成上相差1个或若干个CH2原子团的物质互称为同系物.注意同系物中的“结构相似”是指物质种类相同,若含有官能团,官能团的种类与数目相同,据此进行解答.
解答 解:A.H-OH不是有机物,不是醇,故A错误;
B.CH3OH分子中含有1个羟基,与乙醇相差1个CH2原子团,二者互为同系物,故B正确;
C.HO-CH2-CH2-OH中含有2个羟基,与乙醇结构不相似,二者不属于同系物,故C错误;
D.CH3-O-CH3为甲醚,与乙醇具有相同的分子式,二者互为同分异构体,故D错误.
故选B.
点评 本题考查同系物的概念及判断,题目难度不大,注意掌握同系物、同分异构体等的握概念.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外,还需要的其它玻璃仪器 |
| 12.5g | 250mL | 烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
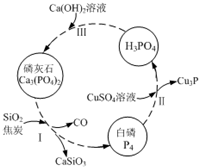 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2I-+Cl2═I2+2Cl- | B. | 2Br-+Cl2═Br2+2Cl- | ||
| C. | Br2+2I-═2Br-+I2 | D. | 2Fe2++I2═2Fe3++2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
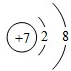 可知,氮原子最外层电子数目为5
可知,氮原子最外层电子数目为5查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com