
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、双氧水中加入稀硫酸和KI溶液:2I-+H2O2+2H+=I2+O2↑+2H2O |
| C、Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D、草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SOCl2是氧化剂,Li是还原剂 |
| B、2 mol SOCl2参加反应,共转移4 mol电子 |
| C、将该反应设计成电池,SOCl2在正极发生反应 |
| D、若将该反应设计成电池,可用稀硫酸作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y形成的化合物一定是气态化合物 |
| B、简单离子半径:W>M>Z>X |
| C、W的氧化物对应的水化物是强酸 |
| D、MZ3中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,有下列合成路线.
,有下列合成路线.
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加 | ①若无明显现象,证明固体中不含 ②若出现 |
| 步骤3:向B试管中滴加 | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: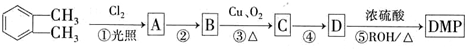
 的名称
的名称 制备DMP的另一种途径:
制备DMP的另一种途径:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com