
| A. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 在反应3Cl2+8NH3═6NH4Cl+N2中,有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g | |
| D. | 等物质的量的CH4和CO所含分子数均为NA |
分析 A、在反应KIO3+6HI═KI+3I2+3H2O中,反应中元素化合价变化计算电子转移;
B、电解精炼铜时,阳极上是粗铜,粗铜上有其他金属杂质;
C、反应3Cl2+8NH3═6NH4Cl+N2中转移6mol电子;
D、CH4和CO的物质的量相等,但不一定是1mol.
解答 解:A、在反应KIO3+6HI═KI+3I2+3H2O中,碘元素化合价+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,每生成3mol I2转移的电子数为5NA,故A正确;
B、电解精炼铜时,阳极上是粗铜,粗铜上有其他比铜活泼的金属杂质也会放电,故阴极得到电子数为2NA时,阳极减少的质量不一定是64g,故B错误;
C、反应3Cl2+8NH3═6NH4Cl+N2中8mol氨气中只有6mol氨气被氧化,转移6mol电子,故当有1.2mol电子转移时,被氧化的是1.2mol氨气,即20.4g,故C错误;
D、CH4和CO的物质的量相等,但不一定是1mol,故分子数不一定是NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | △H>0,△H-T△S<0 | B. | △H<0,△H-T△S>0 | C. | △H>0,△H-T△S>0 | D. | △H<0,△H-T△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时负极反应为:3Zn-6e-═3Zn2+ | |
| B. | 放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| D. | 放电时负极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
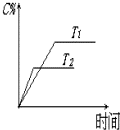 可逆反应aA(s)+bB(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)如图.下列叙述一定正确的是B
可逆反应aA(s)+bB(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)如图.下列叙述一定正确的是B查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)| A. | 该物质能使鲜花长期盛开 | |
| B. | 1mol该物质与NaOH溶液反应,最多消耗1mol NaOH | |
| C. | 该物质既能发生加聚反应,又能发生缩聚反应 | |
| D. | 该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 | |
| E. | 该物质分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
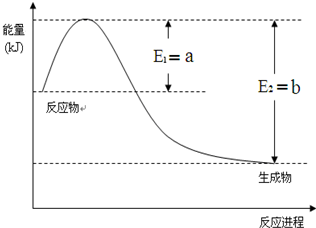 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义查看答案和解析>>
科目:高中化学 来源: 题型:解答题
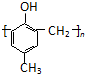 )的合成路线如下:
)的合成路线如下: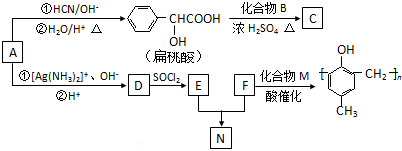
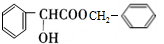 .
. .
.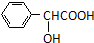 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).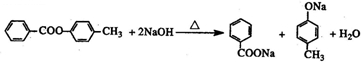 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含K+为2mol的K2SO4溶液 | |
| B. | 将58.5gNaCl溶解于1L水中 | |
| C. | 将0.5mol/L的NaNO3溶液100mL加热蒸发掉50克水的溶液 | |
| D. | 将80gSO3溶于水并配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
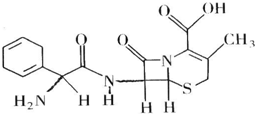 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com