
【题目】下列常见物质的俗名与化学式对应正确的是
A.醋酸——CH3CH2OHB.烧碱——NaOH
C.石灰石——Ca(OH)2D.小苏打——Na2CO3
科目:高中化学 来源: 题型:
【题目】某蓝色荧光材料D的合成路线如下:
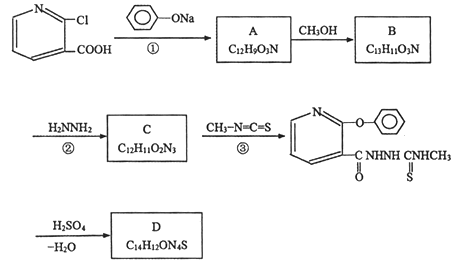
已知:
Ⅰ.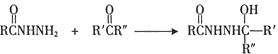
Ⅱ.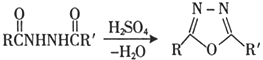
回答下列问题:
(1)①的反应类型为________。
(2)反应②的另一产物为甲醇,其化学方程式为________。
(3)下列说法正确的是________。
A.1molA最多能与7molH2加成 B.化合物B能与FeCl3溶液发生显色反应
C.化合物C具有碱性 D.化合物D的结构简式为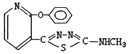
(4)写出同时符合下列条件的化合物![]() 的同分异构体结构简式________。
的同分异构体结构简式________。
①含苯环;②1H-NMR谱表明分子中有2种氢原子。
(5)设计以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中, 正确的是 ( )
A.离子化合物中可能含共价键B.共价化合物中可能含离子键
C.离子化合物中只含离子键D.只含共价键的物质一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。下列说法不正确的是( )
A. C、D、G三种元素形成的盐,水溶液可能呈碱性
B. A与B能形成离子化合物A5B,且既含有离子键又含有共价键
C. B、C、G的简单氢化物中C的氢化物稳定性最强
D. D、E、F、G形成的简单离子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
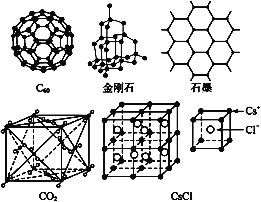
(1)C60、金刚石和石墨三者的关系是互为____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于____(填“原子”或“分子”)晶体,C60分子中含有双键的数目是____。
(3)晶体硅的结构跟金刚石相似,1 mol晶体硅中含有硅—硅单键的数目约是____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有____个与之紧邻且等距的CO2分子;该结构单元平均占有____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为___,每个Cs+周围距离相等且次近的Cs+数目为___,距离为___,每个Cs+周围距离相等且第三近的Cs+数目为____,距离为____,每个Cs+周围紧邻且等距的Cl-数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为:2Br﹣+Cl2=2Cl﹣+Br2 , 下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2) 在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备Mg3N2并进行有关实验。实验装置如下所示:
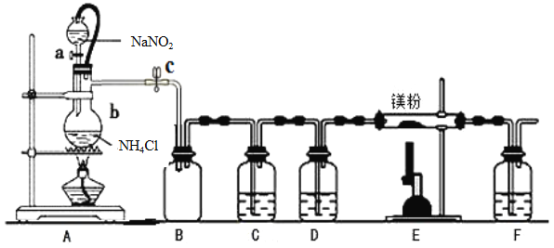
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器a、b的名称分别是____________,____________;写出装置A 中发生反应的化学方程式____________。
(2)装置C中为饱和硫酸亚铁溶液,作用是_________,该装置中发生反应的离子方程式为____________;装置D 中的试剂是____________,F 装置的作用是____________。
(3)加热至反应开始发生,需移走A 处酒精灯,原因是____________。
(4)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是______________。反应的化学方程式为操作的目的是__________;再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下面化学键键能数据,判断下列分子中受热时最不稳定的是( )
化学键 | H-H | H-F | H-Br | H-I |
键能(kJ/mol) | 436 | 565 | 368 | 297 |
A.氢气B.氟化氢C.溴化氢D.碘化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)达到平衡的时间是________,理由是___________________。
(2)如图中表示NO2的浓度变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内各物质的浓度保持不变
c.v逆(NO)=2v正(O2)
d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com