
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
【答案】B
【解析】
醋酸和氨水都是弱电解质,导电能力较弱,氨水与醋酸发生中和反应生成强电解质醋酸铵:CH3COOH+NH3·H2O=CH3COO-+NH4++H2O,溶液中阴、阳离子数目逐渐增多。开始一段时间,溶液中阴、阳离子数目的增加超过溶液体积的增大,溶液中阴、阳离子浓度逐渐增大,溶液导电性逐渐增强;后来溶液的导电性又逐渐减弱,说明后来溶液体积的增大超过了阴、阳离子数目的增加。因此导电能力最强的时刻应为醋酸与氨水恰好完全反应时刻,即加入10mL氨水时醋酸与氨水恰好完全中和,则有物质的量关系:n(CH3COOH)=n(NH3·H2O),设醋酸的原始浓度为c(CH3COOH),建立方程:0.02L×c(CH3COOH)=0.01L×0.2mol/L,解得c(CH3COOH)=0.1mol/L,又原醋酸溶液pH=3,根据电离方程式CH3COOH![]() CH3COO-+H+,原醋酸溶液中已电离的CH3COOH分子浓度=c(H+)=10-3mol/L,因此,醋酸的电离度=
CH3COO-+H+,原醋酸溶液中已电离的CH3COOH分子浓度=c(H+)=10-3mol/L,因此,醋酸的电离度=![]() ×100%=
×100%=![]() ×100%=1%,答案选B。
×100%=1%,答案选B。


科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为1 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C、D均为气态。根据要求回答下列问题:

(1)容器中反应的化学方程式为__________________________________________。
(2)前2 min,v(A)=______mol·(L·min)-1。
(3)能说明该反应已达到平衡状态的是_____________________
A.混合气体的压强不变
B.混合体系中A、B、C、D四种物质同时存在
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=___(保留小数点后两位)。
(5)下列措施能增大该反应的反应速率的是_______________________________(填选项字母)。
A.容器容积不变,加入与反应无关的氖气
B.升高反应体系的温度
C.容器压强不变,加入与反应无关的氖气
D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_______v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究NO2与过氧化钠反应的情况,甲、乙两位同学设计了如下实验,其装置如图。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是________________,仪器B的作用是________________________。
(2)装入药品前必须检查装置的气密性,具体操作方法是________________________。
(3)试管中生成NO2反应的离子方程式是________________________________________。
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是__________。为验证自己的想法,乙同学对上述装置进行了改进,具体做法是________________。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有 _____个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____。
(3) H2Se属于____(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______。
(4) SeO2的立体构型为____。SeO3中Se原子的杂化形式为____。
(5)写出一种与SeO42-互为等电子体的分子式____.
(6)Se能与 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为 ___。
中含有σ键的数目为 ___。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为 ___。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酯的合成方法之一是由酚与酰卤(![]() )反应制得。
)反应制得。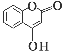 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
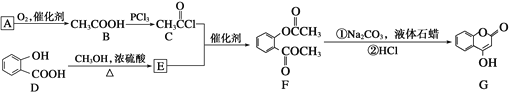
(1)A与银氨溶液反应有银镜生成,则A的结构简式是_________。
(2)B→C的反应类型是_________。
(3)E的结构简式是__________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:__________。
(5)下列关于G的说法不正确的是________(填序号)。
a.能与溴单质反应 b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
(6)写出符合下列要求的D的所有同分异构体的结构简式_____。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
③最多能消耗3molNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构式(键线式)及球棍模型如下,该有机分子的1H核磁共振谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气。关闭B阀时,C处干燥红色布条无变化;打开B阀时,C处干燥红色布条褪色。则D中盛放的试剂不可能的是

A.饱和食盐水B.浓硫酸
C.溴化钠溶液D.氢氧化钙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是 ( )
A. CH3ClB. CH2Cl2C. CCl4D. HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com