
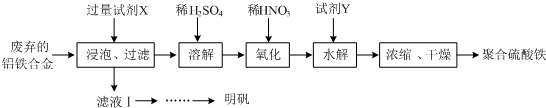

分析 由流程可知,废弃的铝铁合金加入氢氧化钾溶液浸泡反应铝反应得到偏铝酸钾溶液,过滤,滤液经一系列操作反应生成硫酸铝钾,滤渣中加入稀硫酸和铁反应生成硫酸亚铁,加入稀硝酸氧化为硫酸铁,加入试剂Y调节溶液PH,但不能引入新的杂质,加入氧化铁和酸反应来调节溶液PH,酸性越强,对铁离子水解程度抑制越大,生成氢氧化铁少,得到溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到聚合硫酸铁.
(1)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质净水的作用;
②流程中氧化过程是加入的稀硝酸,会引入杂质,可以改为绿色氧化剂如氧气、过氧化氢等,聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇可以利于聚合硫酸铁析出,乙醇易挥发分析;
③加入氧化铁和酸反应来调节溶液PH,不引入新的杂质,图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制;
(2)①明矾是一种常见铝钾硫酸盐,所以为充分利用原料,试剂X应为氢氧化钾;
②明矾溶解度随温度升高溶解度增大,向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤除去过量的废铝铁屑,滤液这是铝和氢氧化钾溶液反应生成偏铝酸钾,加入稀硫酸生成白色沉淀氢氧化铝,继续加入稀硫酸沉淀溶解,所得溶液蒸发浓缩、冷却结晶,过滤,用酒精洗涤晶体,干燥得到明矾晶体.
解答 解(1)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质,有净水的作用,聚合硫酸铁可用于净水的原理是具有吸附作用,
故答案为:聚合硫酸铁具有吸附作用;
②上述流程中的“氧化”设计存在缺陷,流程中氧化过程是加入的稀硝酸,会引入杂质硝酸根离子,可以改为绿色氧化剂如氧气、过氧化氢等,氧气和过氧化氢被还原为水无污染,聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇,可以降低聚合硫酸铁的溶解度利于聚合硫酸铁析出,乙醇易挥发得到晶体易于干燥;
故答案为:将稀HNO3改为H2O2(或O2、O3等);降低聚合硫酸铁的溶解度,以便析出,所得产物易于干燥;
③加入氧化铁和酸反应来调节溶液pH,所加试剂Y为Fe2O3,不引入新的杂质;图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制,分析pH过小(pH<3)导致聚合硫酸铁中x的值减小,
故答案为:Fe2O3;pH过小,会抑制Fe3+的水解;
(2)①明矾是一种常见铝钾硫酸盐,所以为充分利用原料,试剂X应为KOH,故答案为:KOH;
②明矾溶解度随温度升高溶解度增大,向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤除去过量的废铝铁屑,滤液中是铝和氢氧化钾溶液反应生成偏铝酸钾,加入稀硫酸生成白色沉淀氢氧化铝,继续加入稀硫酸沉淀溶解,所得溶液蒸发浓缩、冷却结晶,过滤,用酒精洗涤晶体,干燥得到明矾晶体,
故答案为:向所得滤液中加入稀硫酸,生成白色沉淀,继续滴加稀硫酸至生成的沉淀溶解;蒸发浓缩;冷却结晶.
点评 本题考查了物质的制备实验方案设计,为高考常见题型,侧重考查对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
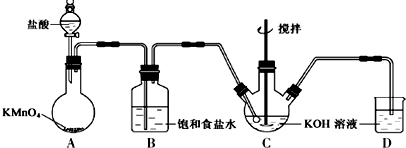
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
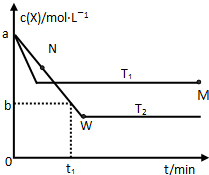 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
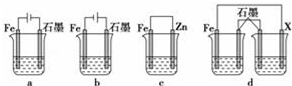
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二溴乙烷:Br2-CH2-CH2-Br | B. | 3,3,4-三甲基己烷: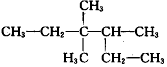 | ||
| C. | 3乙基1丁烯: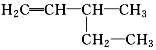 | D. | 2,2,3三甲基戊烷: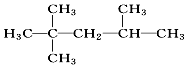 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com