
铁钉和碳棒用导线连接后,浸入到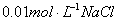 溶液中,可能发生的是( )
溶液中,可能发生的是( )
①碳棒上有氢气析出 ②碳棒附近产生OH- ③碳棒上有氧气析出 ④铁钉被氧化
A、①③
B、①④
C、②③
D、②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
NaCl是从海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(或物质)是
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.全部 B.只有①②③④
C.只有①②③⑤ D.只有①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的电子式_______________________________________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式______________________________________________________________(分解反应)。
(3)下表表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________________________________。
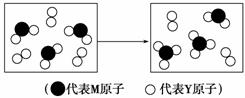
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
醇类化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的醇类香料:
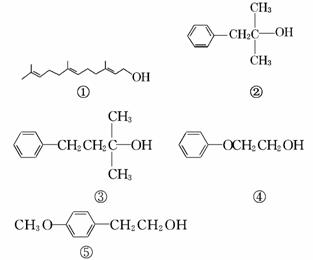
下列说法中正确的是( )
A.可用酸性KMnO4溶液检验①中是否含有碳碳双键
B.②和③互为同系物,均不能催化氧化生成醛或酮
C.④和⑤互为同系物,可用核磁共振氢谱检验
D.等物质的量 的上述5种有机物与足量的金属钠反应,消耗钠的量相同
的上述5种有机物与足量的金属钠反应,消耗钠的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表和电子计算器的电源常用微型银锌原电池,其电极分别为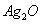 和
和 ,电解质溶液为
,电解质溶液为 溶液,放电时锌极上的电极反应是
溶液,放电时锌极上的电极反应是 ;氧化银电极上的反应式为
;氧化银电极上的反应式为 ,总反应式为
,总反应式为 ,下列说法正确的是( )
,下列说法正确的是( )
A、锌是负极,氧化银是正极
B、锌发生还原反应,氧化银发生氧化反应
C、溶液中OH-向正极移动, 、
、 向负极移动
向负极移动
D、随着电极反应的不断进行,电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应:4Al+3O2+6H2O===4Al(OH)3。下列说法不正确的是( )
A、正极反应式:2H2O+O2+4e-===4OH-
B、电池工作时,电流由铝电极沿导线流向铂电极
C、以网状的铂为正极,可增大与氧气的接触面积
D、该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池产生电流的本质原因是( )
A、原电池中溶液能电离出自由移动的离子
B、有导线将两个活动性不同的电极连接
C、正极发生了氧化反应,而负极发生了还原反应
D、两电极上分别进行的氧化还原反应中有电子的转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、溶液和胶体本质的区别在于胶体能产生丁达尔现象而溶液没有。
B、根据分散剂和分散质的状态(固、液、气)来划分,分散系可分为9种
C、一元中强酸H3PO2的电离方程式为:H3PO2==3H+ + PO23-
D、氧化还原反应本质是元素化合价的升降。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)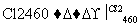 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com