
| A、1个 | B、2个 | C、3个 | D、4个 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:

| A、H2O分解为H2与O2时放出热量 |
| B、生成1mol H2O时吸收热量245kJ |
| C、氢气和氧气的总能量小于水的能量 |
| D、甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol/L的醋酸中,c(H+)=0.1mol/L | ||
| B、在稀醋酸溶液中加入少量醋酸钠固体,会促进醋酸的电离 | ||
| C、在稀氨水中通入氨气,所得溶液的pH减小 | ||
D、向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂 |
| B、配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再加水稀释到所需的浓度 |
| C、测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH |
| D、将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、食盐中阴离子的结构示意图为: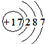 |
| B、蔗糖和醋酸都是弱电解质 |
C、“84消毒液”中有效成分NaClO的电子式为: |
| D、明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,Ⅵ和Ⅶ的结构简式分别为
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,Ⅵ和Ⅶ的结构简式分别为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com