
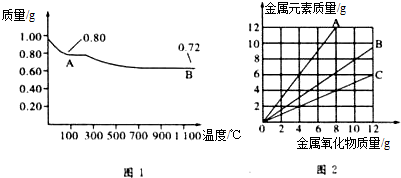
| A. | 图1中,A到B的过程中有0.005mol电子发生了转移 | |
| B. | 图1整个过程中共生成0.18g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A | |
| D. | 图1中A和B化学式分别为Cu2O和CuO |
分析 0.98 g Cu(OH)2的物质的量为$\frac{0.98g}{98g/mol}$=0.01 mol,若完全分解得到CuO,由Cu元素守恒,n(CuO)=0.01 mol,m(CuO)=0.01mol×80g/mol=0.8g,若完全分解得到Cu2O,由Cu元素守恒,n(Cu2O)=$\frac{0.01mol}{2}$=0.005mol,m(Cu2O)=0.005mol×144g/mol=0.72g,故A为CuO、B为Cu2O,
A.由A点到B点发生反应:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,CuO完全分解为Cu2O,结合Cu元素化合价变化计算转移电子;
B.根据H元素守恒计算水的物质的量,再根据m=nM计算生成水的质量;
C.根据CuO的化学式计算CuO中所含Cu元素的质量与CuO的质量之比,结合图象判断;
D.由上述分析可知,A为CuO、B为Cu2O.
解答 解:0.98 g Cu(OH)2的物质的量为$\frac{0.98g}{98g/mol}$=0.01 mol,若完全分解得到CuO,由Cu元素守恒,n(CuO)=0.01 mol,m(CuO)=0.01mol×80g/mol=0.8g,若完全分解得到Cu2O,由Cu元素守恒,n(Cu2O)=$\frac{0.01mol}{2}$=0.005mol,m(Cu2O)=0.005mol×144g/mol=0.72g,故A为CuO、B为Cu2O,
A.由A点到B点发生反应:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑,CuO完全分解为Cu2O,Cu元素化合价由+2价降低为+1价,故转移电子为0.01mol×(2-1)=0.01mol,故A错误;
B.根据H元素守恒,生成水的物质的量为$\frac{0.01mol×2}{2}$=0.01mol,故生成水的质量=0.01mol×18g/mol=0.18g,故B正确;
C.根据CuO的化学式可知CuO中所含Cu元素的质量与CuO的质量之比=64:80=4:5,即曲线斜率为0.8,曲线A的斜率大于1,曲线C的斜率为0.5,曲线B的斜率为0.8,故曲线B表示表示CuO和其中所含Cu元素质量关系,故C错误;
D.由上述分析可知,A为CuO、B为Cu2O,故D错误;
故选B.
点评 本题考查Cu及其化合物的性质,为高频考点,把握极限法判断A、B对应的物质是解题关键,侧重分析、计算能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素的电负性:S>P | B. | 晶体的硬度:碳化硅<晶体硅 | ||
| C. | 酸性:H3PO4<H3PO3 | D. | 热分解温度:CaCO3>BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、E一定处于1、2、3三个不同周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高氧化物的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol.L-1 | v(H2SO4)/mL | 溶液温度反应前/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com