
| A、棕黄、棕红 |
| B、棕黄、苍白 |
| C、棕红、苍白 |
| D、棕红、棕黄 |
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
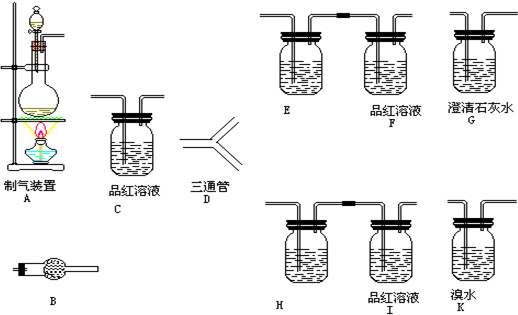
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、NaCl |
| B、Cl2 |
| C、NaClO |
| D、HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
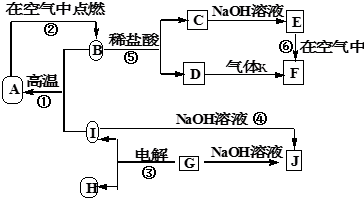
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体. |
| ② | 20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
| ③ | 将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
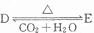 ,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |
| C、用pH=1的盐酸配制100mLpH=2的盐酸需要100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| D、欲配制1.00L1.00mol?L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com