
| A. | 0.4 mol氧气 | B. | 5.4 g H2O | ||
| C. | 标准状况下5.6 L二氧化碳 | D. | 10 g氖 |
分析 微粒个数之比等于物质的量之比,含原子个数最多即原子物质的量最大,由此分析解答.
解答 解:A、氧气为双原子分子,0.4 mol氧气含氧原子为0.8mol;
B、5.4g H2O物质的量为$\frac{5.4g}{18g•mo{l}^{-1}}$=0.3mol,则原子物质的量为0.9mol;
C、标准状况下,5.6 L二氧化碳的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,则原子物质的量为0.75mol;
D、10 g氖的物质的量为0.5mol,氖为单原子分子,则原子物质的量为0.5mol;综上所述,原子数最多的是0.9NA;
故选B.
点评 本题考查物质的量的相关计算,解答本题中注意物质的分子构成,结合相关的计算公式解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
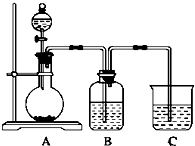
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
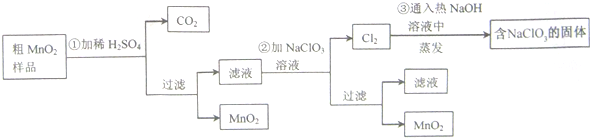
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸 | B. | 金刚石和石墨 | ||
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{17}$O | D. | CH3CH2CH2CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氧化剂是氯酸钾,还原产物是Cl2.
,氧化剂是氯酸钾,还原产物是Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com