
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
分析 A、该反应达到平衡时离子的浓度不变;
B、根据分子式相似的分子,溶度积大的沉淀可以转化为溶度积小的沉淀;
C、反应的平衡常数K=$\frac{c(F{e}^{2+})}{c(P{b}^{2+})}$=$\frac{c(F{e}^{2+})×c({S}^{2-})}{c(P{b}^{2+})×c({S}^{2-})}$=$\frac{Ksp(FeS)}{Ksp(CuS)}$;
D、增大硫离子的浓度平衡左移,c(Fe2+)、c(Pb2+)均减小.
解答 解:A、该反应达到平衡时各离子的浓度保持不变,但不一定相等,故A错误;
B、分子式相似的分子,溶度积大的沉淀可以转化为溶度积小的沉淀,所以FeS的Ksp比PbS的Ksp大,故B正确;
C、反应的平衡常数K=$\frac{c(F{e}^{2+})}{c(P{b}^{2+})}$=$\frac{c(F{e}^{2+})×c({S}^{2-})}{c(P{b}^{2+})×c({S}^{2-})}$=$\frac{Ksp(FeS)}{Ksp(CuS)}$,故C正确;
D、增大硫离子的浓度,平衡左向移动,所以c(Fe2+)、c(Pb2+)均减小,故D正确;
故选A.
点评 本题主要考查了沉淀的平衡以及转化,难度不大,根据平衡移动原理以及沉淀转化的知识即可完成.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ag+) | B. | $\frac{c(C{l}^{-})}{c(B{r}^{-})}$ | C. | c(Cl-) | D. | $\frac{c(A{g}^{+})•c(B{r}^{-})}{c(C{l}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=10的Mg(OH)2浊液C(Mg2+)=10-8 mol•L-1 (已知Mg(OH)2KSP=1×10-16) | |
| B. | 已知AgClKSP=1.8×10-10;Ag2CrO4KSP=1.2×10-12则AgCl的溶解度一定比Ag2CrO4大 | |
| C. | 在饱和AgCl溶液中加入NaI固体不会发生变化 | |
| D. | Fe3+在酸性溶液中一定不会生成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
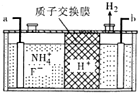 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
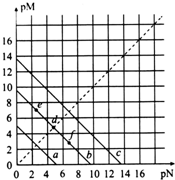 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀 | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com