
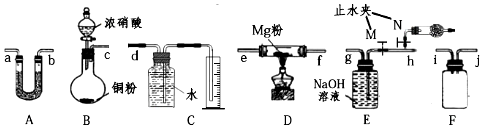
分析 (1)类比Mg与CO2反应的思路对Mg与NO2的反应进行预测并探究Mg与NO2的反应及产物,利用装置B生成二氧化氮气体,通过装置A干燥气体,通过装置D使二氧化氮和镁粉发生反应,通过F防止倒吸,通过装置E吸收二氧化氮气体最后通过装置C测定生成气体体积,验证生成的气体为氮气;
(2)装置A中盛装的干燥剂是干燥生成的二氧化氮气体,不能是溶液,应为固体干燥剂且不与二氧化氮反应,NO2不能用碱性干燥剂干燥,选择酸性或中性固体干燥剂;
(3)二氧化氮气体不能直接排放,用氢氧化钠吸收,装置E是吸收二氧化氮生成硝酸钠和亚硝酸钠,B中仪器分液漏斗用来添加浓硝酸,装置F是安全瓶;
(4)为防止空气干扰实验,排净装置中空气,利用装置E中止水夹,关闭M打开N,使装置充满红棕色气体;
(5)设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=0.55mol,100x+40y=21.0g
解得x=0.05,y=0.4,N2的物质的量为0.05mol,即得到方程;
(6)装置E中 干燥管是防止空气中气体、水蒸气进入,排净空气过程中防止二氧化氮排放到空气中.
解答 解:(1)类比Mg与CO2 反应的思路对Mg与NO2的反应进行预测并探究Mg与NO2的反应及产物,利用装置B生成二氧化氮气体,通过装置A干燥气体,通过装置D使二氧化氮和镁粉发生反应,通过F防止倒吸,通过装置E吸收二氧化氮气体最后通过装置C测定生成气体体积,验证生成的气体为氮气,实验装置连接的顺序为
c-a-b-e-f-i-j-h-g-d,
故答案为:a;b;i;j;h;g;d;
(2)①浓硫酸为溶液不能用U形管干燥气体,故①错误;
②无水CaCl2 为中性固体干燥剂,和二氧化氮不反应,可以干燥二氧化氮气体,故②正确;
③碱石灰为氢氧化钠和氧化钙混合物,和二氧化氮发生反应,不能用来干燥二氧化氮,故③错误;
④五氧化二磷为酸性干燥剂为固体,不与二氧化氮反应,可以用来干燥二氧化氮气体,故④正确;
故答案为:②④;
(3)装置E是吸收二氧化氮生成硝酸钠和亚硝酸钠,反应的化学方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,B装置B中盛放浓硝酸的仪器名称是分液漏斗,用来添加浓硝酸,装置F是安全瓶,起到防止倒吸的作用,
故答案为:2NO2+2NaOH=NaNO3+NaNO2+H2O;分液漏斗;防止倒吸;
(4)为防止空气干扰实验,排净装置中空气,利用装置E中止水夹,关闭M打开N,使装置充满红棕色气体,具体实验操作为打开N,关闭M,滴加浓硝酸,当干燥管中充满红棕色气体时,关闭N
故答案为:打开N,关闭M,滴加浓硝酸,当干燥管中充满红棕色气体时,关闭N;
(5)已知装置E中初始加入Mg粉质量为13.2g,物质的量=$\frac{13.2g}{24g/mol}$=0.55mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g为氮化镁和氧化镁,产生N2的体积为1120mL(标准状况)物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol.
设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=0.55mol,100x+40y=21.0g
解得x=0.05,y=0.4,N2的物质的量为0.05mol,
n(Mg):n(Mg3N2):n(MgO):n(N2)=0.55:0.05:0.4:0.05=11:1:8:1:,结合氮原子守恒NO2前系数为4,
即得到11Mg+4NO2=Mg3N2+8MgO+N2,
故答案为:11Mg+4NO2=Mg3N2+8MgO+N2;
(6)在设计上若没有干燥管,在充满二氧化氮气体过程中二氧化氮会排放到空气中污染环境,若没有干燥管不行,因为干燥管的作用是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气,
故答案为:不行,因为干燥管的作用是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气.
点评 本题考查了物质组成和性质的实验探究方法和组成的测定分析,实验基本操作和物质组成的计算是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
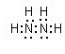 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C溶于水后得到强碱溶液,则A可能是Na | |
| B. | 若向C溶液中逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐消失,则A可能Al | |
| C. | 若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2 | |
| D. | 若C的溶液中滴加NaOH产生白色沉淀,后白色沉淀消失,则B可能为Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
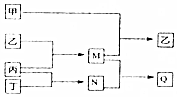 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 原子半径的大小m>q>n>p | |
| B. | 元素非金属性q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com