
分析 (1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
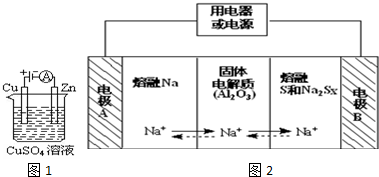
(2)①电解池的阴极上是阳离子发生得电子的还原反应;
②根据转移电子数目相等,分析解答;
(3)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答.
解答 解:(1)16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,32g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)①与电源负极相连的是电解池的阴极,在阴极上阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
②铜为阳极,发生氧化反应,铜片质量变化128g,转移电子的物质的量为$\frac{128g}{64g/mol}$×2=4mol,所以消耗Li的质量质量为4mol×7g/mol=28g,故答案为:28;
(3)①放电时,Na被氧化,应为原电池负极,故答案为:负;
②阳离子向正极移动,即从A到B,故答案为:从A到B;
③充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-=xS.
点评 本题是一道有关热化学和电化学知识的综合考察知识题目,侧重于学生的分析能力的考查,注意把握电解池的工作原理以及电极方程式的书写,答题时注意体会,难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
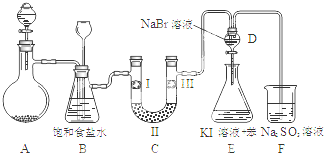
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
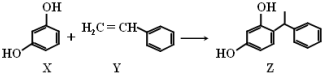
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
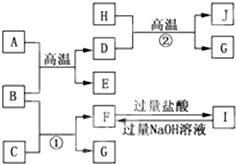 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱溶液洗涤沾有油污的器具 | |
| B. | 用食醋除去热水瓶胆中积存的水垢 | |
| C. | 用米汤检验加碘盐中含有碘 | |
| D. | 用灼烧并闻气味的方法区分化纤物质与纯毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com