
| A. | m+11 | B. | m+4 | C. | m-6 | D. | m-5 |
分析 根据化合物X2Y3,则X元素的化合价为+3价,Y元素的化合价为-2价,则X可能为B或Al元素,Y可能为O或S元素,还存在特殊情况为X为N元素,Y为O元素形成的化合物.
解答 解:A、若化合物X2Y3为B2S3,B的核电荷数为5,S的为16,已知X的核电荷数为n,则Y的核电荷数为m+11,故A有可能;
B、根据价序原则,化合价为奇数的,核电荷数为奇数,化合价为偶数的,核电荷数为偶数,则X、Y的核电荷数之差不可能为偶数4,因奇数和偶数的差与和还是奇数,故B不可能;
C、根据价序原则,化合价为奇数的,核电荷数为奇数,化合价为偶数的,核电荷数为偶数,则X、Y的核电荷数之差不可能为偶数6,因奇数和偶数的差与和还是奇数,不可能为C;
D、若化合物X2Y3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为m,则Y的核电荷数为m-5,故D有可能;
故选BC.
点评 本题考查化合价与化学式及核电荷数的关系,为高频考点,把握常见的化合物中的元素的化合价及元素的核电荷数的关系为解答的关键,能利用举例的方法或价序原则来分析解答,题目难度不大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和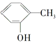 为同系物 ⑥
为同系物 ⑥ 和
和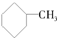 为芳香化合物( )
为芳香化合物( )| A. | ①③④⑥ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
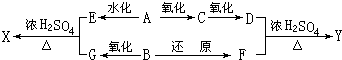
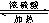 HCOOC2H5+H2O.
HCOOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com