
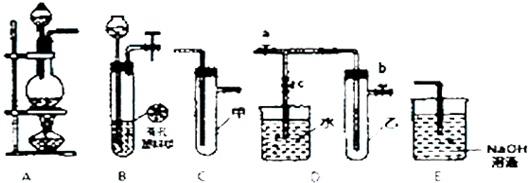
分析 (1)将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,利用气体的压强检验气密性;
(2)用锌粒和稀硫酸制备H2,选择固体与液体反应装置,且不需要加热;夹紧止水夹后反应会慢慢停止下来,气体使固液分离;
(3)设计实验证明Cl2氧化性强于Br2,利用A装置制备氯气,C装置发生氯气与NaBr的反应,E装置尾气处理;
(4)将B、D、E装置连接后,在B装置中加入铜片和浓硝酸制取NO2,然后进行NO2气体与水反应的实验,B中Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,D装置中的具支试管乙中收集满NO2气体,关闭止水夹a、b,打开止水夹c,适当加热试管乙,可使二氧化氮与水反应生成NO,以此来解答.
解答 解:(1)在进行气体制备时,应先检验装置的气密性.将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后打开分液漏斗开关,水不能顺利流下,则气密性良好或打开分液漏斗开关水不能持续滴下或分液漏斗中液面长期保持不变,则气密性良好,
故答案为:打开分液漏斗开关,水不能顺利流下,则气密性良好或打开分液漏斗开关水不能持续滴下或分液漏斗中液面长期保持不变;
(2)用锌粒和稀硫酸制备H2,选择固体与液体反应装置,且不需要加热,则选择装置B;夹紧止水夹后反应会慢慢停止下来,原因为试管中气压增大,将溶液压回长颈漏斗中,使固液分离而停止,
故答案为:B;试管中气压增大,将溶液压回长颈漏斗中,使固液分离而停止;
(3)设计实验证明Cl2氧化性强于Br2,利用A装置制备氯气,C装置发生氯气与NaBr的反应,E装置尾气处理,
①由上述分析可知,连接顺序为A→C→E,故答案为:A;C;E;
②利用浓盐酸与二氧化锰制备氯气,C中试剂为NaBr,即该实验需要的试剂为b、c、e,故答案为:b、c、e;
③实验过程中能说明Cl2氧化性强于Br2的实验现象是C中溶液的颜色变为(橙)黄色,故答案为:C中溶液的颜色变为(橙)黄色;
(4)①B中Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应关闭止水夹a、b,打开止水夹c,然后再适当加热乙,实验现象为烧杯中的水进入试管中,试管中气体颜色变浅,
故答案为:关闭止水夹a、b,打开止水夹c;乙;烧杯中的水进入试管中,试管中气体颜色变浅.
点评 本题考查性质实验方案的设计,为高频考点,把握常见气体的制备原理、性质实验设计、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:实验题
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
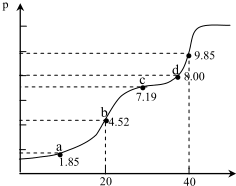
| A. | a 点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b 点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-) | |
| C. | c 点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d 点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 | B. | 0.10 | C. | 0.04 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.6 | B. | 13 | C. | 13.5 | D. | 13.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
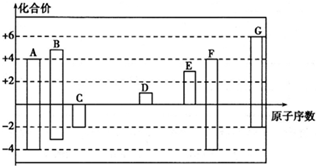
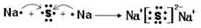 .其所含化学键类型为离子键.
.其所含化学键类型为离子键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com