
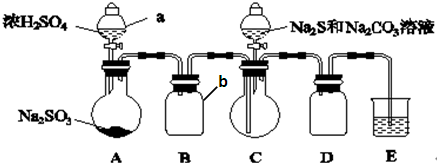
分析 浓硫酸和亚硫酸钠反应生成二氧化硫,用B装置收集二氧化硫,C中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,D为安全瓶,防倒吸,二氧化硫有毒不能直接排空,用碱液吸收尾气,
Ⅱ.(1)利用压强差检验装置气密性;仪器b是安全瓶;E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠溶液反应,与稀H2SO4和饱和NaHSO3溶液不反应;
(3)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法;
Ⅲ.(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl;硝酸、硫酸、盐酸等性质比较可知;
(2)根据亚硫酸钠易被氧化生成硫酸钠分析;
(3)根据重结晶的适用范围分析.
解答 解:浓硫酸和亚硫酸钠反应生成二氧化硫,用B装置收集二氧化硫,C中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,D为安全瓶,防倒吸,二氧化硫有毒不能直接排空,用碱液吸收尾气,
Ⅱ.(1)利用压强差检验装置气密性,其检验方法为连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
仪器b是安全瓶;E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠、亚硫酸钠溶液反应,但亚硫酸钠吸收二氧化硫较慢,与稀H2SO4和饱和NaHSO3溶液不反应,所以E中试剂为氢氧化钠;
故答案为:连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
安全瓶;D;
(3)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法,故答案为:洗涤;
Ⅲ.(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;防止Na2SO3被空气中的氧气氧化;
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶.
点评 本题以某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了物质的分离提纯、检验、设计优化等,侧重考查学生分析、基本操作、实验方案设计等能力,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 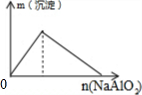 向盐酸中滴入NaAlO2溶液 | B. | 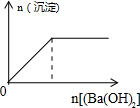 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 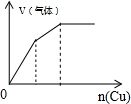 将铜粉加入到一定浓硝酸中 | D. | 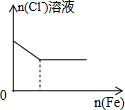 将铁粉加入到一定量氯化铁溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com