
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
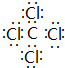 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.分析 短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.
解答 解:短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.
(1)E为碳元素,原子有2个电子层,最外层电子数为4,处于周期表中第二周期第ⅣA族;C与D形成的化合物为AlCl3,属于共价化合物,
故答案为:第二周期第ⅣA族;共价化合物;
(2)A2B2为Na2O2,晶体中存在的化学键:离子键、共价键,故答案为:离子键、共价键;
(3)由D、E组成的分子呈正四面体结构的化合物Y为CCl4,电子式为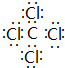 ,Na在真空压下能与化合物CCl4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,该物质为金刚石,另外物质为氯化钠,反应方程式为4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C,
,Na在真空压下能与化合物CCl4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,该物质为金刚石,另外物质为氯化钠,反应方程式为4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C,
故答案为: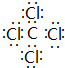 ;4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
;4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(4)溶液中存在平衡:ClO-+H2O?HClO+OH-,常温下,0.1mol•L-1 NaClO溶液的pH>7,水解得到的HClO具有强氧化性,可以做家用消毒剂,故答案为:>;ClO-+H2O?HClO+OH-;
(5)A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2,反应中Na2O2既是氧化剂又是还原剂,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Na2O2;Na2O2.
点评 本题考查结构性质位置关系,难度中等,根据元素化合物性质及原子结构推断元素是解题的关键.


科目:高中化学 来源: 题型:选择题
 )其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
)其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
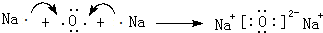 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ca(HCO3)2溶液与少量的NaOH溶液混合2HCO3-+Ca2++2OH-═2 H2O+CaCO3↓+CO32- | |
| C. | 磁性氧化铁溶液与稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | NH4HCO3溶液与过量的NaOH溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 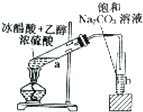 |
| A.验证甲烷与氯气发生化学反应 | B.实验室制取乙酸乙酯 |
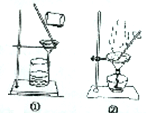 |  |
| C.提取含杂质的粗苯甲酸 | D.提纯含杂质的工业酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
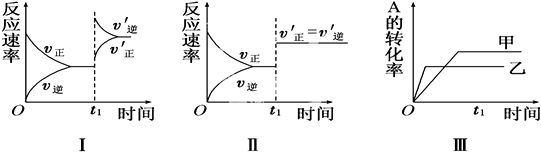
| A. | 图Ⅰ表示的是t1时刻升高温度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 | |
| D. | 图Ⅲ表示的是温度对平衡的影响,且乙的温度比甲高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com