
【题目】某溶液中有![]() 、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
A.只有![]() B.Mg2+ 、Fe2+C.
B.Mg2+ 、Fe2+C.![]() 、Fe2+D.全部
、Fe2+D.全部
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某种苯的同系物0.1mol 在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:①3∶1∶1②1∶1∶2∶6③3∶2④3∶2∶2∶2∶1,请分别推断出其对应的结构:①_______;②_________________;③___________;④___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 可以写成
可以写成![]() 。有机物A的结构如下图所示,请回答:
。有机物A的结构如下图所示,请回答:

(1)有机物A分子所含官能团的名称为__________________。
(2)1mol A最多与____mol H2在一定条件下反应可生成环烃B。
(3)有机物A的分子式为_____________________________。
(4)有机物C是A的同分异构体,属于芳香烃,且C在一定条件下可发生聚合反应,生成高分子化合物D。则C的结构简式为______________,D的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
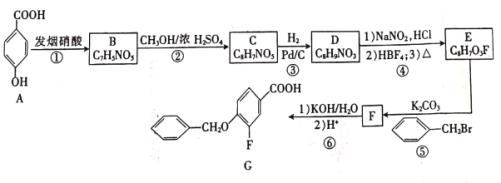
【题目】在医药工业中,有机物 G是一种合成药物的中间体 ,其合成路线如图所示 :
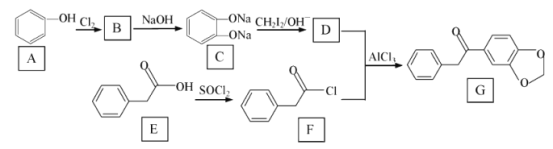
已知:R1ONa+R2X→R1OR2+NaX(R1与 R2代表苯环或烃基、X 代表卤素原子)
RCOOH+SOCl2(液体)→RCOCl+HCl↑+SO2↑
回答下列问题:
(1)A 与C在水中溶解度更大的是 _________ , G 中官能团的名称是 ___________。
(2)E→F 的有机反应类型是 ________ ,F 的分子式为______________。
(3)由A→B反应的化学方程式为 ___________________。
(4)物质D的结构简式为 _________________。
(5)B→C 反应中加入NaOH 的作用是________________。
(6)写出一种符合下列条件的G的同分异构体 _________________ 。
①与G的苯环数相同;②核磁共振氢谱有5 个峰;③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
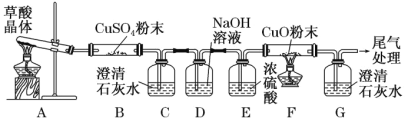
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
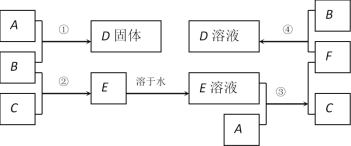
请回答:
(1)写出A、B、C的化学式。A:___________________ B:___________________ C:____________________
(2)反应①的化学方程式为:________________________________________________
(3)反应③的化学方程式为:________________________________________________
(4)反应④的离子方程式为:________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
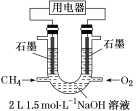
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研究人员发现茶叶中的EGCG能有效阻断新冠病毒S蛋白与人体ACE2受体的结合。制备EGCG的中间体G的一种合成路线如下:
已知: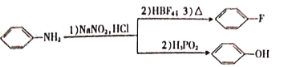
回答下列问题:
(1)G中官能团的名称是______。
(2)反应①的反应类型是____________。
(3)F与KOH溶液反应的化学方程式为__________________。
(4)芳香族化合物X与D互为同分异构体,其中属于硝酸酯(![]() )的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
)的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
(5)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。下列关于EGCG(结构简式如图)的说法错误的是______(填标号)。
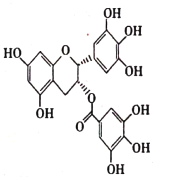
A.含有两种官能团
B.分子中含有两个手性碳原子
C.能与![]() 溶液发生显色反应
溶液发生显色反应
D.1 mol EGCG与NaOH溶液反应,最多消耗8 mol NaOH
(6)1,4—苯并二恶烷(![]() )是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
)是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
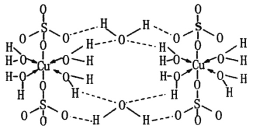
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com